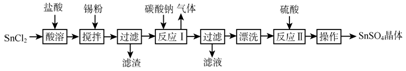
题目内容
4.PH3 是一种无色剧毒气体.下列判断错误的是( )| A. | PH3 分子是非极性分子 | |
| B. | PH3分子中有一对电子孤对 | |
| C. | PH3 分子VSEPR模型的名称是四面体 | |
| D. | PH3 分子稳定性低于 NH3 分子 |
分析 A.分子结构是三角锥型,正负电荷重心不重合,为极性分子;
B.PH3 分子结构和 NH3 相似;
C.价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;
D.共价键键长越短,键能越大,分子越稳定.
解答 解:A.PH3分子结构是三角锥型,正负电荷重心不重合,为极性分子,故A错误;
B.PH3 分子结构和 NH3 相似,中心原子都含有一个孤电子对,故B正确;
C.PH3分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,VSEPR模型为四面体结构;含有一个孤电子对,所以其空间构型为三角锥形,故C正确;
D.共价键键长越短,键能越大,分子越稳定,P-H键键能比N-H键键能低,是因为P的原子半径比N大,P-H键长比N-H长,则N-H键键长更短、键能更高,所以PH3分子稳定性低于NH3分子,故D正确;
故选A.
点评 本题考查了化学键、分子构型等,会利用知识迁移法进行分析解答,注意价层电子对互斥模型(简称VSEPR模型)理解,和氨气类推性质比较,题目难度不大.

练习册系列答案
相关题目
14. 与氢气加成产物的名称是( )
与氢气加成产物的名称是( )
 与氢气加成产物的名称是( )
与氢气加成产物的名称是( )| A. | 4-甲基己烷 | B. | 2-乙基戊烷 | C. | 1,3-二甲基戊烷 | D. | 3-甲基己烷 |
12.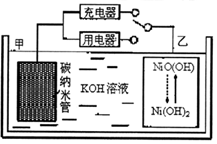 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 电池总反应为H2+2NiOOH$?_{放电}^{充电}$2Ni(OH)2 | |
| B. | 放电时,甲电极为负极,OH-移向乙电极 | |
| C. | 放电时,乙电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
19.新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2.请设计实验证明有O2生成将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成,将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不
一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
(3)已知室温下,H2CO3?HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-?CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO?H++ClO-Ka(HClO)=2.95×10-8
HCN?H++CN-Ka(HCN)=5×10-10
①少量CO2通入NaCN溶液中的化学方程式CO2+H2O+NaCN=HCN+NaHCO3少量的氯气通入到过量的碳酸钠溶液中的离子方程式Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是a>b>c;
③室温下0.05mol/L NaCN溶液的pH为11.
(1)HClO不稳定,见光易分解生成HCl和O2.请设计实验证明有O2生成将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成,将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不
一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①氯气使布条褪色 ②盐酸使布条褪色 ③次氯酸使布条褪色 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:把红色布条伸入稀盐酸中,红色布条不褪色 实验③:把红色布条伸入氯水中,红色布条褪色 实验④:把红色布条放在水里,布条不褪色. | 结论: 次氯酸使布条褪色 |
HCO3-?CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO?H++ClO-Ka(HClO)=2.95×10-8
HCN?H++CN-Ka(HCN)=5×10-10
①少量CO2通入NaCN溶液中的化学方程式CO2+H2O+NaCN=HCN+NaHCO3少量的氯气通入到过量的碳酸钠溶液中的离子方程式Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是a>b>c;
③室温下0.05mol/L NaCN溶液的pH为11.
9.下列说法不正确的是( )
| A. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 天然氨基酸能溶于强碱或强酸溶液,是两性化合物 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
16.下列化学变化属于取代反应的是( )
| A. | 甲烷在空气中完全燃烧 | |
| B. | 在镍做催化剂的条件下,苯与氢气反应 | |
| C. | 乙烯通入溴水中 | |
| D. | 乙醇与乙酸制备乙酸乙酯 |
13.下列说法正确的是( )
| A. | 按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 麻黄碱(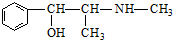 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 | |
| D. | 某分子式为C10H20O2的酯可发生如图所示的转化过程,则符合条件的酯的结构有4种 |
14.下列关于卤族元素结构和性质的说法错误的是( )
| A. | F、Cl、Br、I原子半径依次增大 | |
| B. | F、Cl、Br、I的电子层数逐渐增多 | |
| C. | F2、Cl2、Br2、I2的氧化性逐渐减弱 | |
| D. | F-、Cl-、Br -、I-离子的还原性依次减弱 |