题目内容
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7。
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;③室温下,若生成同浓度的NaCl与NH4Cl溶液各1L,则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
(1)①>;<(每空1分) ②M++H2O MOH+H+(2分)
MOH+H+(2分)
(2)V1=V2<V3;V1>V2>V3;>(每空2分)
解析试题分析:(1)①醋酸是弱酸,存在电离平衡,因此pH=4的醋酸溶液的浓度大于10-4mol/L。氢氧化钠是强碱,完全电离,则常温下pH=10的氢氧化钠溶液浓度等于10-4mol/L,因此混合前c(CH3COOH)>c(NaOH );两者等体积混合后醋酸过量,溶液显酸性,所以混合后溶液的pH<7。
②由于a+b=14,两者等体积混合后溶液显碱性,若溶液是由于水解显碱性,则酸一定是弱酸。但如果算是弱酸,则酸一定过量,溶液应该显酸性,才假设不正确。所以只能是碱过量导致溶液显碱性,因此碱是弱碱,则生成的盐中M+水解,该水解反应的离子方程式为M++H2O MOH+H+。
MOH+H+。
(2)①氢氧化钡和氢氧化钠是强碱,在溶液体积和pH相等的条件下消耗的盐酸的物质的量相同,所以在盐酸的浓度相等的条件下,消耗盐酸的体积是V1=V2;氨水是弱碱,存在电离平衡,所以在pH相等的条件下氨水的浓度大于氢氧化钠溶液的浓度,消耗的盐酸体积最多,因此V1、V2、V3的大小关系是V1=V2<V3;
②氢氧化钡和氢氧化钠是强碱,在溶液体积和物质的量浓度相等的条件下消耗的盐酸的物质的量前者多,因此在盐酸的浓度相等的条件下,消耗盐酸的体积是V1>V2;氨水是弱碱,与盐酸恰好反应时溶液显酸性,若要显中性,则氨水应该是过量的,所以消耗盐酸的体积应该是V2>V3,则V1、V2、V3的大小关系是V1>V2>V3;
③由于氯化铵溶液中NH4+水解,而钠离子不水解,所以等体积等浓度的NaCl与NH4Cl溶液中离子总数大小关系是N(NaCl) >N(NH4Cl)。
考点:考查弱电解质的电离、盐类水解、酸碱中和反应、溶液酸碱性判断

(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。
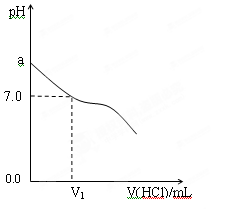
①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程 。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是 。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是 。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是 。
③乙同学这样配制混合溶液的理由是 。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: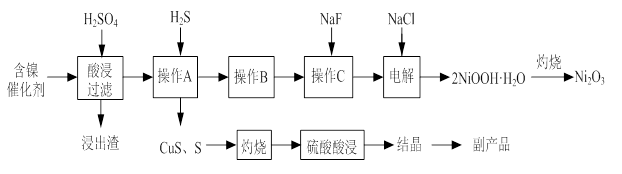
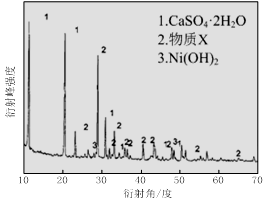
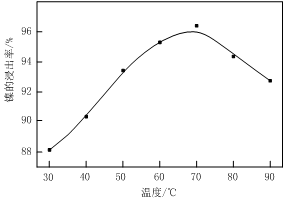
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 ______mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
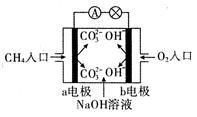
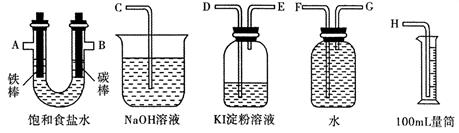
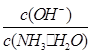 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。