题目内容
3.不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2,则下列推断正确的是( )| A. | 正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1mol水蒸气,转移电子4mol | |
| D. | 放电时正极发生氧化反应 |
分析 该在燃料电池中,燃料在负极失电子发生氧化反应,氧气在正极得电子发生氧化反应,根据反应中电子的转移与反应物的关系求转移电子的物质的量;在电池内部阴离子向负极移动,阳离子向正极移动,据此进行分析.
解答 解:A.该燃料电池燃料为H2,电解质为熔融的K2CO3总反应为2H2+O2=2H2O,负极反应为2H2+2CO32--4e-═2H2O+2CO2,用总反应减负极得正极反应式:O2+2CO2+4e-═2CO32-,故A错误;
B.在电池内部阴离子向负极移动,所以电池工作时,CO32-移向负极,故B正确;
C.根据总反应2H2+O2=2H2O,H2中H由零价变为H2O中H+1价,转移2个电子,每生成2molH2O,转移4mol电子,故C错误;
D.放电过程中负极失去电子发生氧化反应,正极得到电子发生还原反应,故D错误;
故选B.
点评 本题考查了原电池原理,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,题目难度不大.

练习册系列答案
相关题目
13.具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法不正确的是( )

| A. | 可以与溴水反应 | |
| B. | 可以与FeCl3溶液发生显色反应 | |
| C. | 可以与浓HBr溶液反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
14.150℃,101kPa下,将下列有机物分别与足量的空气混合,引燃反应后恢复到原来的温度和压强,气体体积不变的是( )
| A. | C2H6 | B. | C2H4 | C. | C3H8 | D. | C3H6 |
15.决定化学反应速率的主要原因是( )
| A. | 物质本身的性质 | B. | 反应物的浓度 | ||
| C. | 反应的温度 | D. | 反应物间的接触面积 |
12.甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示,对所得分子的描述,正确的是( )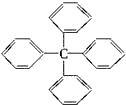

| A. | 此物质分子式为C25H18,属于苯的同系物 | |
| B. | 其一氯代物共有四种 | |
| C. | 此分子最多有13个碳原子在一个平面上 | |
| D. | 该物质能使溴水因化学反应而褪色 |
13.下列分离或提纯物质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | 硬脂酸钠 | 甘油,水 | 加NaCl | 盐析 |
| B | 乙烷 | 乙烯 | 通过KMnO4(H+)溶液 | 洗气 |
| C | C6H6 | Br2 | 加苯酚 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$ +
+
 ;理论上B也可以由1,3-丁二烯与烃F来合成,则F的名称(系统命名法):2-丁炔;C中含有的官能团的名称是羰基和羧基.
;理论上B也可以由1,3-丁二烯与烃F来合成,则F的名称(系统命名法):2-丁炔;C中含有的官能团的名称是羰基和羧基. ;它与E不互为(填“互为”或“不互为”)同分异构体.
;它与E不互为(填“互为”或“不互为”)同分异构体.