题目内容
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
| A.②③①④ | B.③②①④ |
| C.③①②④ | D.①②③④ |
B
解析试题分析:①金属钠在纯氧中燃烧生成淡黄色的过氧化钠;②FeSO4溶液中滴入NaOH溶液,有白色絮状沉淀生成,然后迅速变为浅绿色,最后变为红褐色;③FeCl3溶液中滴入KSCN溶液,发生络合反应,溶液呈红色;④无水硫酸铜放入医用酒精中,医用酒精中含有水,溶液变蓝,故其产物的颜色按红、红褐色、淡黄色、蓝色顺序排列的是③②①④,答案选B。
考点:考查常见物质的性质
点评:该题是基础性试题的考查,难度不大。试题紧扣教材基础知识,意在巩固学生的基础,提高学生的学习效率。答题时注意反应产物的判断,注意常见物质的颜色等物理性质。

下列对实验现象的预测不正确的是
| A.向氢氧化铁胶体中滴加盐酸至过量,先有沉淀出现,后沉淀溶解 |
| B.向Ca(ClO)2溶液中通人CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
| C.向CaCl2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
| D.向Ca(OH)2溶液中通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失 |
根据下列实验现象得出的结论,正确的是
| 选项 | 实验现象 | 结论 |
| A | 某气体能使润湿的淀粉碘化钾试纸变蓝 | 该气体一定是氯气 |
| B | 向某溶液中加入盐酸酸化的BaCl2,有白色沉淀生成 | 该溶液中一定存在SO42- |
| C | 铁与稀硝酸充分反应后,溶液呈浅绿色 | 稀硝酸与铁反应只能生成Fe2+ |
| D | SO2通入溴水中,溴水褪色 | SO2具有还原性 |
下列有关化学反应过程的叙述中,错误的是
| A.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| B.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶 |
| C.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| D.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体 |
对下列实验现象的描述不正确的是
| A.光亮的金属Na暴露在空气中,表面逐渐变暗 |
| B.将SO2通入品红溶液,品红溶液褪色 |
| C.将Mg(OH)2固体投入FeCl3溶液中,无明显现象 |
| D.浓硫酸与Cu混合加热,可能有白色固体析出 |
下列说法正确的是
| A.硅和石墨都是重要的半导体材料 |
| B.SO2、NO2、CO2都会导致酸雨的形成 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理不同 |
| D.氢能是清洁能源,工业上用电解水法制大量氢气符合节能减排理念 |
I、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为: .其电极均由石墨材料做成,则电解时不断消耗的电极是 ;(填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 ;
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,则负极的电极反应式为 ,正极附近溶液的pH (填变大、不变或变小)。
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。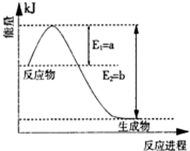
(1)图是在一定温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出合成氨的热化学反应方程: (△H的数值用含字母a、b的代数式表示)。
(2)工业合成氨反应如下,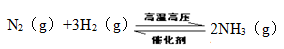
在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:

有3mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。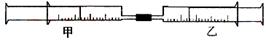
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40 mL HCl | 40 mLNH3 | 产生白烟 |
| 2 | 40 mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30 mL NO | 15 mL O2 | |
| 4 | 20 mL AlCl3溶液 | 10 mL NaOH溶液 | 生成白色沉淀,后消失 |
(2)由实验2可知,常温常压下氯气在水中的溶解度为 。
(3)实验3 反应后甲针筒内气体的体积为 。
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。

(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
①A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
②已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。

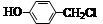 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。