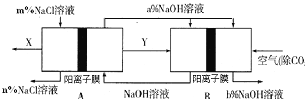
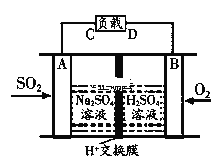
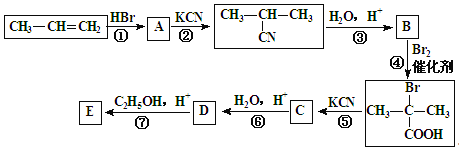
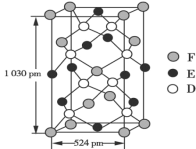
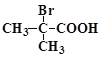题目内容
【题目】下列文字表述与反应方程式对应且正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+===2Fe3++3H2O
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=== AlO2-+4NH4++2H2O
D.向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O![]() CaSO3↓+2HClO
CaSO3↓+2HClO
【答案】B
【解析】
A.Fe3+能将I-氧化,所以氧化铁溶于氢碘酸,发生反应的离子方程式为:Fe2O3+6H++2I-==2Fe2++I2+3H2O,A不正确;
B.KHCO3和Ba(OH)2等摩混合,可假设两种溶质都为1mol,则参加反应的HCO3-、Ba2+、OH-都为1mol,从而得出发生反应:HCO3-+Ba2++OH-==BaCO3↓+H2O,B正确;
C.Al(OH)3不溶于氨水,所以向氯化铝溶液中加入过量氨水,发生反应:Al3++3NH3·H2O== Al(OH)3↓+3NH4+,C不正确;
D.向Ca(ClO)2溶液中通入少量SO2,ClO-能将H2SO3氧化为H2SO4,ClO-被还原为Cl-,发生反应的方程式为:Ca2++3ClO- +SO2+H2O==CaSO4↓+Cl- +2HClO,D不正确;
故选B。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】研究氮族元素有关物质的结构、性质和转化有重要意义。
⑴已知P4、P4O6的结构及所含化学键键能如下:
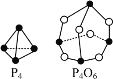
化学键 | P-P | P-O | O=O |
键能(kJ·mol-1) | a | b | c |
则P4燃烧的热化学反应方程式:P4(s)+3O2(g)=P4O6(s) ΔH=_______kJ·mol-1。
⑵亚磷酸(H3PO3) 是一种精细化工产品。已知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。0.1 mol·L-1 NaH2PO3溶液中H3PO3、H2PO![]() 、HPO
、HPO![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
⑶雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。一定条件下,雌黄和雄黄的转化关系如图1所示。
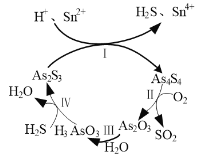
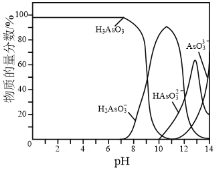
图1 图2
①反应Ⅰ的离子方程式为______。
②反应Ⅱ中,若1 mol As4S4参加反应,转移电子的物质的量为______。
⑷常温下,用NaOH溶液滴定H3AsO3溶液,含As微粒的物质的量分数随pH的变化如图2所示。
①将NaOH溶液滴加到滴有酚酞的H3AsO3溶液中,当溶液由无色变为红色时主要反应的离子方程式为______。
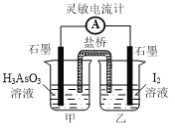
②一定条件下H3AsO3可发生如下反应: H3AsO3+I2+H2O![]() H3AsO4+2H++2I-利用该反应可设计如图所示的原电池。负极的电极反应式为_______。当反应达到平衡后,向甲中加
H3AsO4+2H++2I-利用该反应可设计如图所示的原电池。负极的电极反应式为_______。当反应达到平衡后,向甲中加
入NaOH,盐桥中阴离子_______(填“向甲池”、 “向乙池”或“不”)移动。
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断

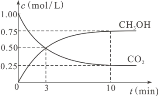
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。