题目内容
短周期元素 X、Y、Z 可组成化学式均为 XYZ3 的四种化合物甲、乙、丙、丁.
(1)若甲中 X 的原子只有一个质子,Y、Z均是第二周期元素,则 Y 元素原子的电子排布式为 ; X、Y 原子间可形成与烷烃结构类似的化合物,则该系列化合物的通式为 .
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10-6,且 X、Y、Z 三种元素的原子序数之和为 26,Y、Z 同周期,则乙的溶解平衡可表示为 ,其饱和溶液中X的离子的物质的量浓度约为 mol/L.
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 .
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为 .
(1)若甲中 X 的原子只有一个质子,Y、Z均是第二周期元素,则 Y 元素原子的电子排布式为
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10-6,且 X、Y、Z 三种元素的原子序数之和为 26,Y、Z 同周期,则乙的溶解平衡可表示为
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为
分析:(1)X的原子只有一个质子,X为H元素,短周期元素 X、Y、Z 可组成化学式为XYZ3 的化合物,在化合物中H显+1价,YZ3为-1价原子团,Y、Z均是第二周期元素,则Y是N元素,Z是O元素;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,则乙是碳酸镁,X是镁,Y是C 元素,Z是O元素;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的盐,所以丙是氯酸钠;
(4)若丁中 X、Y、Z 处于不同周期,X 原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素.
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,则乙是碳酸镁,X是镁,Y是C 元素,Z是O元素;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的盐,所以丙是氯酸钠;
(4)若丁中 X、Y、Z 处于不同周期,X 原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素.
解答:解:(1)X的原子只有一个质子,X为H元素,短周期元素 X、Y、Z 可组成化学式为XYZ3 的化合物,在化合物中H显+1价,YZ3为-1价原子团,Y、Z均是第二周期元素,则Y是N元素,Z是O元素,
Y原子核外有7个电子,其核外电子排布式为1s22s22p3,H、N原子间可形成与烷烃结构类似的化合物,氮原子成3个共价键,设N原子数目为n,每形成1个N-N键减少2个H原子,则H原子数目为3n-2(n-1)=n+2,故则该系列化合物的通式为NnHn+2,
故答案为:1s22s22p3;NnHn+2;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,X是镁,Y是C 元素,Z是O元素,则乙是碳酸镁,碳酸镁的溶解平衡可表示为MgCO3(s)?Mg2+(aq)+CO32-(aq),其饱和溶液中Mg2+离子与CO32-离子浓度相等,故饱和溶液中Mg2+离子的物质的量浓度约为
mol/L=2.61×10-3mol/L,
故答案为:MgCO3(s)?Mg2+(aq)+CO32-(aq);2.61×10-3;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的盐,则Z是O元素,所以丙是氯酸钠,氯酸钠和浓盐酸反应生成氯化钠、氯气和水,反应方程式为:NaClO3+6HCl(浓)═3Cl2↑+NaCl+3H2O,
故答案为:NaClO3+6HCl(浓)═3Cl2↑+NaCl+3H2O;
(4)若丁中 X、Y、Z 处于不同周期,X 原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素,丁是三氯甲烷,三氯甲烷是四面体结构,其结构式为 ,
,
故答案为: .
.
Y原子核外有7个电子,其核外电子排布式为1s22s22p3,H、N原子间可形成与烷烃结构类似的化合物,氮原子成3个共价键,设N原子数目为n,每形成1个N-N键减少2个H原子,则H原子数目为3n-2(n-1)=n+2,故则该系列化合物的通式为NnHn+2,
故答案为:1s22s22p3;NnHn+2;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,X是镁,Y是C 元素,Z是O元素,则乙是碳酸镁,碳酸镁的溶解平衡可表示为MgCO3(s)?Mg2+(aq)+CO32-(aq),其饱和溶液中Mg2+离子与CO32-离子浓度相等,故饱和溶液中Mg2+离子的物质的量浓度约为
| 6.8×10-6 |
故答案为:MgCO3(s)?Mg2+(aq)+CO32-(aq);2.61×10-3;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的盐,则Z是O元素,所以丙是氯酸钠,氯酸钠和浓盐酸反应生成氯化钠、氯气和水,反应方程式为:NaClO3+6HCl(浓)═3Cl2↑+NaCl+3H2O,
故答案为:NaClO3+6HCl(浓)═3Cl2↑+NaCl+3H2O;
(4)若丁中 X、Y、Z 处于不同周期,X 原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素,丁是三氯甲烷,三氯甲烷是四面体结构,其结构式为
 ,
,故答案为:
 .
.点评:本题考查位置结构关系、物质推断等,正确推断元素化合物是解本题的关键,难度中等,(2)为易错点、难点,需要学生具有扎实的基础知识与运用的能力.

练习册系列答案
相关题目
 短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表的位置如图所示,其中X元素所处的周期序数与族序数相等.下列判断正确的是( )| A、气态氢化物的稳定性:Y>Z | B、一定条件下,Z单质与W的常见单质直接反应生成ZW2 | C、原子半径:X>Y>Z>W | D、Y、Z的最高价氧化物均为共价化合物 |
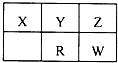 短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )
短周期元素X、Y、Z、R和W在元素周期表的位置如图所示,其中W元素族序数等于周期序数的2倍.则下列说法正确的是( )| A、原子半径从小到大:X<Y<R<W | B、Z、W元素与X均可以形成AB2型化合物 | C、X有多种同素异形体,而Z不存在同素异形体 | D、Z的氢化物稳定性大于W的氢化物稳定性,是因为Z的氢化物分子间存在氢键 |
 短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n.W原子最内层电子数是最外层电子数的2倍.下列说法错误的是( )
短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n.W原子最内层电子数是最外层电子数的2倍.下列说法错误的是( )| A、X 和Y都是非金属元素,其中X最高化合价为+5价 | B、X、W的最高价氧化物在一定条件下能反应 | C、元素X、W和氧元素可形成化学式为W2XO3共价化合物 | D、Y、Z的氢化物的稳定性:Y<Z |


