题目内容
14. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H2 3.36L | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
分析 A.根据c=$\frac{1000ρω}{M}$计算出该硫酸的浓度,然后判断是否产生氢气;
B.根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析;
C.根据配制溶液前后溶质的物质的量不变来计算;
D.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量.
解答 解:A.该硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,该硫酸为浓硫酸,常温下铝遇浓硫酸时钝化,不会产生氢气,故A错误;
B.根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O及Cu与稀硫酸可知,随反应的进行,浓硫酸变为稀硫酸,生成二氧化硫的体积小于0.05L×18.4mol/L×0.5×22.4L/mol=10.3L,故B错误;
C.根据配制溶液前后溶质的物质的量不变可知,需取该硫酸的体积为:$\frac{0.2L×4.6mol/L}{18.4mol/L}$=0.05L=50mL,故C正确;
D.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故D错误;
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,明确信息利用c=$\frac{1000ρω}{M}$计算浓度时解答本题的关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
19.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从下口放出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线 | |
| C. | 用淘洗的方法从沙里淘金 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
4.有X、Y两种元素,相对原子质量分别为56、16,化合价分别为+3和-2,则X和Y组成的化合物的相对分子质量为?( )
| A. | 72 | B. | 88 | C. | 160 | D. | 200 |
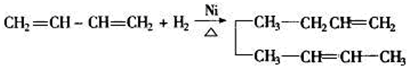
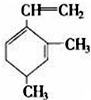 ,当它与等物质的量的Br2的水溶液发生加成反应时有多种产物,请补写除给出的两种结构外的其他三种产物的结构简式.
,当它与等物质的量的Br2的水溶液发生加成反应时有多种产物,请补写除给出的两种结构外的其他三种产物的结构简式.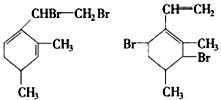
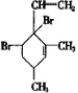
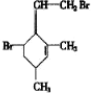
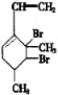 .
.
 .
. .
. 、
、 .
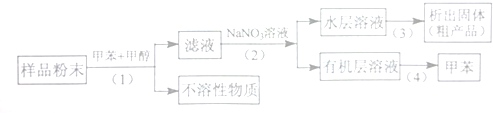
. )的合成路线流程图如下:
)的合成路线流程图如下:
 ,③的反应类型为加成反应.
,③的反应类型为加成反应. .
.