��Ŀ����
��������һ����������Ũ���ᷴӦ��ת��Ϊ����泥�������Ũ����������Һ��ˮ���������£����е�Ԫ�ؿ�ת��Ϊ������������30.0mL��ţ�̽�������ʵ�飬��ţ���еĵ�������ĵ�Ԫ����ȫת��Ϊ��������50.0ml0.500mol?L-1������Һ���������İ���ʣ�������38.0ml1.00mol?L-1����������Һ��ǡ����ȫ�кͣ��ʣ�
��1��30.0mLţ���к��ж���g����
��2������������к���16%����������������ţ���е����ʵ����������Ƕ��٣�����֪ţ���ܶ���1.03g?mL-1��
��1��30.0mLţ���к��ж���g����
��2������������к���16%����������������ţ���е����ʵ����������Ƕ��٣�����֪ţ���ܶ���1.03g?mL-1��
���㣺��ѧ����ʽ���йؼ���
ר�⣺������
��������1�������������Ƽ���ʣ������ᣬ���������백����Ӧ����������ʵ������ٸ��ݹ�ϵʽ2N��2NH3��H2SO4���㵪Ԫ�ص�������
��2������m=��V����30mLţ�̵�������m��ţ�̣����أ������ʣ����أ���������NԪ�أ�=m��ţ����NԪ�أ����ݴ˼��㵰��������������
��2������m=��V����30mLţ�̵�������m��ţ�̣����أ������ʣ����أ���������NԪ�أ�=m��ţ����NԪ�أ����ݴ˼��㵰��������������
���
�⣺��1����38mL1.00mol?L-1�� NaOH��Һ�к���������ʵ���Ϊn����
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.038L��1mol/L n
��ã�n=0.038L��1mol/L��
=0.019mol
�����հ�������������ʵ���Ϊ��0.500mol?L-1��0.05mL-0.019mol=0.006mol
��30.0mLţ���е�Ԫ�ص�������m����
2N��2NH3��H2SO4
28g 1mol
m 0.006mol
����m=28g��
=0.168g
��30.0mLţ���е�Ԫ�ص�������0.168g��
��2��30mLţ�̵�����Ϊ��30mL��1.03g?mL-1=30.9g
����30.9g���أ������ʣ���16.0%=0.168g
��ã��أ������ʣ�=3.4%
�𣺸�ţ���е����ʵ���������Ϊ3.4%��
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.038L��1mol/L n
��ã�n=0.038L��1mol/L��
| 1 |
| 2 |
�����հ�������������ʵ���Ϊ��0.500mol?L-1��0.05mL-0.019mol=0.006mol
��30.0mLţ���е�Ԫ�ص�������m����
2N��2NH3��H2SO4
28g 1mol
m 0.006mol
����m=28g��
| 0.006mol |
| 1mol |
��30.0mLţ���е�Ԫ�ص�������0.168g��
��2��30mLţ�̵�����Ϊ��30mL��1.03g?mL-1=30.9g
����30.9g���أ������ʣ���16.0%=0.168g
��ã��أ������ʣ�=3.4%
�𣺸�ţ���е����ʵ���������Ϊ3.4%��
���������⿼����ݷ���ʽ�ļ��㡢�����������йؼ��㣬�ѶȲ�����NԪ���غ�ȷ���������е�Ԫ�������ᷴӦ�Ĺ�ϵʽ�ǽ���ؼ���

��ϰ��ϵ�д�
 �������ϵ�д�
�������ϵ�д�
�����Ŀ
0.1mol/L CH3COONaϡ��Һ�У���������Ũ�ȹ�ϵ����ȷ���ǣ�������
| A��c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� |
| B��c��Na+����c��CH3COO-����c ��OH-����c��H+�� |
| C��c��CH3COO- ��+c��CH3COOH��=0.1 mol/L |
| D��c��Na+����c��CH3COO-����c ��H+����c��OH-�� |

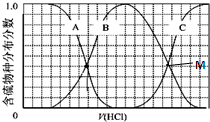 ���ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�ã�
���ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�ã�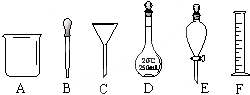 ����ͼA��F����������
����ͼA��F����������