题目内容
2.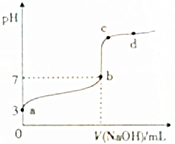 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中:c(H+)>c(CH3COO-)>c(OH-) | |
| B. | b点时,V(NaOH)=20mL | |
| C. | c点表示的溶液中:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) | |
| D. | d点表示的溶液中:c(Na+)>c(CH3COO-) |
分析 A.a点为醋酸溶液,其pH=3,c(H+)=10-3mol/L,根据溶液中电荷守恒判断醋酸根离子与氢离子浓度关系;
B.b点时,溶液显示中性,根据V(NaOH)=20mL时溶液的组成来判断;
C.c点根据电荷守恒来判断;
D.d点溶液显示碱性,c(OH-)>c(H+),根据电荷守恒可知c(Na+)>c(CH3COO-).
解答 解:A.a点为醋酸溶液,根据图象可知c(H+)=10-3mol/L,根据电荷守恒可知:c(H+)=c(CH3COO-)+c(OH-),所以点表示的溶液中c(CH3COO-)<c(H+)=10-3mol/L,c(H+)>c(CH3COO-)>c(OH-),故A正确;
B.b点时,溶液显示中性,c(H+)=c(OH-),V(NaOH)=20mL,溶液生成醋酸钠,应该是碱性,pH>7,故B错误;
C.c点时,氢氧化钠过量,溶液显示碱性,溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故C正确;
D.d点时,氢氧化钠过量,溶液显示碱性,则溶液中一定满足c(OH-)>c(H+)、c(Na+)>c(CH3COO-),故D正确;
故选B.
点评 本题考查了酸碱混合后的定性判断及溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,能够根据电荷守恒、物料守恒等比较溶液中离子浓度大小,试题培养了学生灵活应用的所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.对以下描述的解释或结论中,正确的是( )
| 选项 | 描述 | 解释或结论 |
| A | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 溶液中含SO42- |
| B | Cl2+H2O=HClO+HCl | Cl2仅为还原剂,HCl为氧化产物 |
| C | PH=1的溶液中Fe2+、Al3+、SO42-、MnO4-不能大量共存 | 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
| D | SO2使酸性高锰酸钾溶液和品红试液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
10.如图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )


| A. | t1时,只有正方向反应 | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度不再发生变化 |
7.我国是世界最大的耗煤国家,下列加工方法不属于煤的综合利用的是( )
| A. | 干馏 | B. | 气化 | C. | 液化 | D. | 裂解 |
14.甲醇低压羰基合成法(CH3OH+CO→CH3COOH)是当今世界醋酸生产的主要方法,国标优等品乙酸含量≥99.8%.为检验得到的乙酸中是否含有甲醇,可用的方法是( )
| A. | 观察放入金属Na是否产生气泡 | |
| B. | 观察滴入的紫色石蕊溶液是否变红 | |
| C. | 观察滴入的酸性KMnO4溶液是否褪色 | |
| D. | 观察插入的表面发黑的灼热铜丝是否变红 |
12.下列各组混合物,不论两种物质以何种比例混合,只要总质量一定,经完全燃烧后,产生的CO2的质量不变的是( )
| A. | 乙炔和苯酚 | B. | 乙醇和乙酸 | C. | 甲醛和葡萄糖 | D. | 丙烯和丙烷 |
 (1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.
(1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形. 已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.
已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.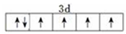 ;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.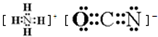 .
.
 、C
、C .
. .
. .
. .
.