题目内容
下表为周期表前20号元素中某些元素的有关数据:
试回答下列问题:(以下各题回答,可能的话,均用对应的元素符号或物质的化学式表示)
(1)写出⑨与氢元素形成的常见阳离子的电子式
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是 、 ;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是
(4)①、④、⑦、⑩四种元素形成的离子,其半径由小到大的顺序为 .
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 1.43 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)写出⑨与氢元素形成的常见阳离子的电子式
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是
(4)①、④、⑦、⑩四种元素形成的离子,其半径由小到大的顺序为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)氯化铵离子化合物,化合物中含有铵根离子和氯离子之间的离子键,还有铵根内部的共价键;
(2)若|元素化合价|+元素原子的最外层电子数=8,则原子就满足最外层为8电子的稳定结构;
(3)1.04×10-10m介于1.10×10-10m和0.99×10-10m之间;
(4)电子层越多半径越大,核外电子数一样,核内质子数越多,半径越小.
(2)若|元素化合价|+元素原子的最外层电子数=8,则原子就满足最外层为8电子的稳定结构;
(3)1.04×10-10m介于1.10×10-10m和0.99×10-10m之间;
(4)电子层越多半径越大,核外电子数一样,核内质子数越多,半径越小.
解答:
解:元素的最高正价=最外层电子数=族序数,同主族元素原子,从上到下原子半径逐渐增大,故⑩为F,⑦为Cl,①为Na,②为Li,⑧为K,同周期元素的原子,从左到右原子半径逐渐减小,③无最高价,最低价为-2,故为O,④的半径比钠小,比Si大,最外层电子数为3,应为Al,⑤的半径比O大,最外层电子数为4,故为C,⑥的半径比Cl大,最外层电子数为,应为P,⑨的半径介于C和O之间,应为N,
(1)氯元素、氮元素与氢元素形成的常见离子化合物为氯化铵,电子式为 ,故答案为:
,故答案为: ;
;
(2)|元素化合价|+元素原子的最外层电子数=8,则原子就满足最外层为8电子的稳定结构,C、Cl、P中某2种元素形成的化合物中,只有CCl4、PCl3符合等式,
故答案为:CCl4、PCl3;
(3)1.04×10-10m介于1.10×10-10m和0.99×10-10m之间,即半径大小介于P和Cl之间,故为S,位于第三周期,第ⅥA族,故答案为:第三周期,第ⅥA族;
(4)电子层越多半径越大,则Cl-半径最大,对于具有核外电子数一样多的离子来说,核内质子数越多,半径越小,则Al3+<Na+<F-,故答案为:Al3+<Na+<F-<Cl-.
(1)氯元素、氮元素与氢元素形成的常见离子化合物为氯化铵,电子式为
 ,故答案为:
,故答案为: ;
;(2)|元素化合价|+元素原子的最外层电子数=8,则原子就满足最外层为8电子的稳定结构,C、Cl、P中某2种元素形成的化合物中,只有CCl4、PCl3符合等式,
故答案为:CCl4、PCl3;
(3)1.04×10-10m介于1.10×10-10m和0.99×10-10m之间,即半径大小介于P和Cl之间,故为S,位于第三周期,第ⅥA族,故答案为:第三周期,第ⅥA族;
(4)电子层越多半径越大,则Cl-半径最大,对于具有核外电子数一样多的离子来说,核内质子数越多,半径越小,则Al3+<Na+<F-,故答案为:Al3+<Na+<F-<Cl-.
点评:本题是一道关于原子结构和元素周期律的推断题,考察的知识面较广,难度较大,要求学生熟记教材知识,学以致用.

练习册系列答案
相关题目
下列变化规律中正确的是( )
| A、金属Na、Mg、A1熔、沸点由高到低 |
| B、HC1、HBr、HI的还原性由强到弱 |
| C、H+、Li+、H- 的半径由小到大 |
| D、同浓度的硫酸钠、醋酸钠、碳酸钠溶液的碱性由强到弱 |
在以下各种情形下,下列电离方程式或离子方程式书写正确的是( )
| A、熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- |
| B、H2CO3的电离:H2CO3?2H++CO32- |
| C、Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- |
| D、Na2CO3的水解:CO32-+2H2O?H2CO3+2OH- |
下列说法正确的是( )
A、按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 |
| B、将1-溴丙烷和饱和氢氧化钾乙醇溶液共热,产生的气体通过酸性高锰酸钾溶液,溶液褪色,一定能证明1-溴丙烷发生了消去反应 |
C、纤维素  和壳聚糖 和壳聚糖 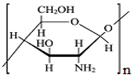 均属于多糖 均属于多糖 |
D、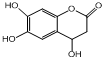 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |