题目内容
在KClO3+6HCl=3Cl2↑+ KCl+3H2O中,有30 mole-转移,生成的氯气在标准状况下的体积为( )
| A.22.4L | B.336.0L | C.403.2L | D.672.0L |
B
解析试题分析:从题中可知,每生成3molCl2↑,就有5mol电子发生转移,那么当有30 mole-转移时,生成的氯气为18mol,在标准状况下的体积为403.2L,选C。
考点:考查氧化还原反应。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
| A.NH4CuSO3中硫元素被氧化了 |
| B.刺激性气味的气体是二氧化硫和氨气的混合气体 |
| C.该反应中NH4CuSO3既作氧化剂又作还原剂 |
| D.该反应中硫酸既表现为酸性又表现强氧化性 |
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A.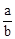 mol·L-1 mol·L-1 | B.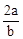 mol·L-1 mol·L-1 | C.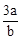 mol·L-1 mol·L-1 | D.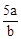 mol·L-1 mol·L-1 |
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32﹣和Cl2反应的产物之一为SO42﹣.下列说法不正确的是( )
| A.该反应中还原剂是S2O32﹣ |
| B.H2O参与该反应,且作氧化剂 |
| C.根据该反应可判断氧化性:Cl2>SO42﹣ |
| D.上述反应中,每生成l mol SO42﹣,可脱去2mol Cl2 |
下列反应中必须加入氧化剂才能进行的是( )
| A.Cl2→Cl- | B.Zn2+→Zn | C.H2→H2O | D.CuO→CuCl2 |
下列自然、生活中的事例不属于氧化还原反应的是
| A.动物呼吸 | B.植物光合作用 | C.金属生锈 | D.石膏点制豆腐 |
下列反应中氯元素仅被还原的是
| A.5Cl2+I2+6H2O=10HCl+2HIO3 |
| B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| D.HCl+NaOH=NaCl+H2O |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中Na2FeO4是还原产物 |
| C.Na2FeO4 中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3发生反应,转移电子的物质的量为 6 mol |