题目内容
19.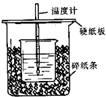 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)①先判断温度差的有效性,然后求出温度差平均值;
②a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测得的热量偏小;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2组舍去,温度差平均值=$\frac{4.0℃+3.9℃+4.1℃}{3}$=4.0℃,
故答案为:4.0;
②a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评 本题考查反应热的测定,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.

练习册系列答案
相关题目
10. 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
①表中3min~4min之间反应处于平衡状态; C1数值大于0.08mol/L(填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
14.下表是元素周期表的一部分,其中a、b、c、d、e、f各代表一种元素,请回答下列问题:
(1)最简单的有机物是由b元素和a(填字母)元素组成的;
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为 .
.
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为
 .
.
4.己知金属钾投入水中会发生剧烈反应,并有氢气生成.运输金属钾的包装箱应贴有的图标是( )
| A. |  易燃液体 | B. |  遇湿易燃物品 | C. |  氧化剂 | D. |  腐蚀品 |
11.已知在K2Cr2O7的溶液中存在如下平衡:
Cr2O72-+H2O?2CrO42-+2H+ K2Cr2O7为橙色,K2 CrO4为黄色.取两只试管各加入5ml0.1mol/L K2Cr2O7溶液,然后按如表步骤操作.
回答:(1)本实验除试管外还必须使用的一种玻璃仪器是:胶头滴管.
(2)1号实验的现象是:溶液橙色加深;结论是:增大生成物浓度平衡向逆方向移动;
(3)2号实验的现象是:溶液黄色加深;结论是:减小生成物浓度平衡向正方向移动.
Cr2O72-+H2O?2CrO42-+2H+ K2Cr2O7为橙色,K2 CrO4为黄色.取两只试管各加入5ml0.1mol/L K2Cr2O7溶液,然后按如表步骤操作.
| 编号 | 1 | 2 |
| 步骤 | 滴加3~10滴浓硫酸 | 滴加10~20滴6mol/LNaOH溶液 |
(2)1号实验的现象是:溶液橙色加深;结论是:增大生成物浓度平衡向逆方向移动;
(3)2号实验的现象是:溶液黄色加深;结论是:减小生成物浓度平衡向正方向移动.
8.下列物质中能够导电的是( )
| A. | 蔗糖溶液 | B. | 盐酸溶液 | C. | 二氧化碳气体 | D. | 氯化钠固体 |
9.下列单质或化合物性质的描述正确的是( )
| A. | Na2CO3的溶解性比NaHCO3小 | |
| B. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| C. | FeCl3溶液制作铜质印刷线路板的离子反应为2Fe3++Cu═2Fe2++Cu2+ | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |

 氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:
氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下: