题目内容
(1)2.5mol Ba(OH)2中含有 个Ba2+,含有 个OH-,25mol Ba(OH)2的质量是 g.
(2)0.3mol NH3分子中所含原子数与 个H2O分子中所含原子数相等.
(3)含有0.4mol Al3+的Al2(SO4)3溶液中所含SO
的质量是 g.
(4)46g NO2和N2O4的混合气体其分子数最多接近 ,最少接近 ,氧原子数目为 .
(2)0.3mol NH3分子中所含原子数与
(3)含有0.4mol Al3+的Al2(SO4)3溶液中所含SO
2- 4 |
(4)46g NO2和N2O4的混合气体其分子数最多接近
考点:物质的量的相关计算
专题:计算题
分析:(1)钡离子物质的量等于氢氧化钡的物质的量,而氢氧根物质的量等于氢氧化钡的2倍,根据N=nNA计算Ba2+、OH-离子数目;根据m=nM计算25mol Ba(OH)2的质量;
(2)计算氨气含有原子物质的量,进而计算水的物质的量,再根据N=nNA计算水分子数目;
(3)n(SO42-)=
n(Al3+),根据m=nM计算SO42-的质量;
(4)存在平衡2NO2?N2O4,只有NO2时含有分子数目最多,只有N2O4时含有分子数目最少,NO2和N2O4混合气体中O元素质量分数为
,据此计算氧原子质量,再根据n=
计算O原子物质的量,再根据N=nNA计算O原子数目.
(2)计算氨气含有原子物质的量,进而计算水的物质的量,再根据N=nNA计算水分子数目;
(3)n(SO42-)=
| 3 |
| 2 |
(4)存在平衡2NO2?N2O4,只有NO2时含有分子数目最多,只有N2O4时含有分子数目最少,NO2和N2O4混合气体中O元素质量分数为
| 32 |
| 46 |
| m |
| M |
解答:
解:(1)n(Ba2+)=n[Ba(OH)2]=2.5mol,故含有Ba2+离子数目=2.5mol×6.02×1023mol-1=1.505×1024,n(OH-)=2n[Ba(OH)2]=2×2.5mol=5mol,故含有OH-离子数目=5mol×6.02×1023mol-1=3.01×1024,
25mol Ba(OH)2的质量=25mol×171g/mol=4275g;
故答案为:1.505×1024;3.01×1024;4275;
(2)0.3mol氨气含有原子物质的量=0.3mol×4=1.2mol,与0.3mol氨气含原子数相等的H2O的物质的量=
=0.4mol,故水分子数目=0.4mol×6.02×1023mol-1=2.408×1023,
故答案为:2.408×1023;
(3)n(SO42-)=
n(Al3+)=
×0.4mol=0.6mol,SO42-的质量=0.6mol×96g/mol=57.6g,
故答案为:57.6;
(4)存在平衡2NO2?N2O4,只有NO2时含有分子数目最多,分子数最多接近为
×6.02×1023mol-1=6.02×1023,只有N2O4时含有分子数目最少,分子数最少接近为
×6.02×1023mol-1=3.01×1023,
NO2和N2O4混合气体中O元素质量分数为
,氧原子质量=46g×
=32g,O原子物质的量=
=2mol,故含有O原子数目=2mol×6.02×1023mol-1=1.204×1024,
故答案为:6.02×1023;3.01×1023;1.204×1024.
25mol Ba(OH)2的质量=25mol×171g/mol=4275g;
故答案为:1.505×1024;3.01×1024;4275;
(2)0.3mol氨气含有原子物质的量=0.3mol×4=1.2mol,与0.3mol氨气含原子数相等的H2O的物质的量=
| 1.2mol |
| 3 |
故答案为:2.408×1023;
(3)n(SO42-)=
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:57.6;
(4)存在平衡2NO2?N2O4,只有NO2时含有分子数目最多,分子数最多接近为
| 46g |
| 46g/mol |
| 46g |
| 92g/mol |
NO2和N2O4混合气体中O元素质量分数为
| 32 |
| 46 |
| 32 |
| 46 |
| 32g |
| 16g/mol |
故答案为:6.02×1023;3.01×1023;1.204×1024.
点评:本题考查物质的量有关计算,比较基础,(4)中注意分析化学式确定氧元素质量分数,注意对基础知识的理解掌握.

练习册系列答案
相关题目
放射性核素53125I可用于治肿瘤,该核素中子数是( )
| A、19 | B、53 | C、72 | D、125 |
在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)?C(g)△H<0.开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是( )
| A、再充入2mol A,平衡正移,A的转化率增大 |
| B、如果升高温度,C的体积分数增大 |
| C、如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小 |
| D、再充入1mol C,C的物质的量浓度将增大 |
下列条件下能大量共存的离子组是( )
| A、在含有大量Fe3+的溶液中:K+、Na+、Cl-、SCN- |
| B、使酚酞试液变红的溶液:Ca2+、K+、HCO3-、NO3-、NO3- |
| C、某强酸性溶液中:K+、Na+、I-、MnO4- |
| D、在c(H+)=1.0×10-13mol?L-1的溶液中:Na+、NO3-、[Al(OH)4]-、SO32- |

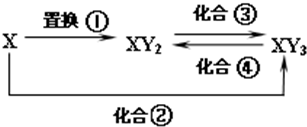 元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,
元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,