题目内容
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图1所示(气密性已检验,部分夹持装置略):
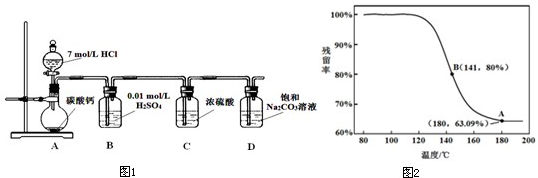
(1)D中产生NaHCO3的化学方程式是 .
(2)请结合化学平衡移动原理解释B中溶液的作用 .
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用.为确定固体的成分,各实验小组设计方案如下(称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀.根据该实验现象,判断能否确定D中固体的成分并说明理由 .
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生.该实验小组分析现象后认为D中固体存在NaHCO3,其离子方程式是 ;但不能确定是否存在Na2CO3,你认为该结论是否合理? .
③方案3:甲、乙两同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3.为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 .
乙同学:利用仪器测定了固体残留率(残留物=
×100%),随温度变化的曲线,如图2所示.
根据B点坐标,计算残留固体中NaHCO3与Na2CO3的物质的量之比n(NaHCO3):n(Na2CO3)= .

(1)D中产生NaHCO3的化学方程式是
(2)请结合化学平衡移动原理解释B中溶液的作用
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用.为确定固体的成分,各实验小组设计方案如下(称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀.根据该实验现象,判断能否确定D中固体的成分并说明理由
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生.该实验小组分析现象后认为D中固体存在NaHCO3,其离子方程式是
③方案3:甲、乙两同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是
乙同学:利用仪器测定了固体残留率(残留物=
| 剩余固体的物质 |
| 原始固体的物质 |
根据B点坐标,计算残留固体中NaHCO3与Na2CO3的物质的量之比n(NaHCO3):n(Na2CO3)=
考点:制备实验方案的设计,有关混合物反应的计算
专题:实验题
分析:(1)由图可知,A中生成二氧化碳,在D中二氧化碳与碳酸钠、水反应生成碳酸氢钠;
(2)B中酸可抑制二氧化碳的溶解;
(3)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳;Na2CO3和BaCl2溶液混合也能生成沉淀;
③甲同学:蒸发后冷却,测定pH,可确定固体存在碳酸氢钠,补充实验为对比性实验;
乙同学:a.A点说明碳酸氢钠分解,残留率为63.09%;
b.B点残留率为80%,以此利用差量法计算.
(2)B中酸可抑制二氧化碳的溶解;
(3)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳;Na2CO3和BaCl2溶液混合也能生成沉淀;
③甲同学:蒸发后冷却,测定pH,可确定固体存在碳酸氢钠,补充实验为对比性实验;
乙同学:a.A点说明碳酸氢钠分解,残留率为63.09%;
b.B点残留率为80%,以此利用差量法计算.
解答:
解:(1)由图可知,A中生成二氧化碳,在D中二氧化碳与碳酸钠、水反应生成碳酸氢钠,该反应为Na2CO3+CO2+H2O═2NaHCO3,
故答案为:Na2CO3+CO2+H2O═2NaHCO3;
(2)B中酸可抑制二氧化碳的溶解,则B中溶液的作用为CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体,
故答案为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;
(3)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,所以无法确定固体的成分中是否含有NaHCO3,
故答案为:不能,Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,离子反应为2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;Na2CO3和BaCl2溶液混合也能生成沉淀,则不能确定是否存在Na2CO3,结论合理,
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;合理;
③甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是冷却到室温,加水至溶液体积为400mL,再次测定pH,可确定固体存在碳酸氢钠,补充实验为取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照,
故答案为:冷却到室温,加水至溶液体积为400mL,再次测定pH;取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照;
乙同学:A点说明碳酸氢钠分解,残留率为63.09%,可知白色固体为碳酸氢钠(NaHCO3),
B点残留率为80%,设原固体100g,则B点残留固体为80g,设生成碳酸钠为x,则
2NaHCO3
Na2CO3+CO2↑+H2O△m
106 62
x 100g-80g
=
,解得x=34.2g,
n(NaHCO3)=
=0.55mol,
n(Na2CO3)=
=0.32mol,n(NaHCO3):n(Na2CO3)≈1.7,
故答案为:1.7.
故答案为:Na2CO3+CO2+H2O═2NaHCO3;
(2)B中酸可抑制二氧化碳的溶解,则B中溶液的作用为CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体,
故答案为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;
(3)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,所以无法确定固体的成分中是否含有NaHCO3,
故答案为:不能,Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,离子反应为2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;Na2CO3和BaCl2溶液混合也能生成沉淀,则不能确定是否存在Na2CO3,结论合理,
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;合理;
③甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是冷却到室温,加水至溶液体积为400mL,再次测定pH,可确定固体存在碳酸氢钠,补充实验为取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照,
故答案为:冷却到室温,加水至溶液体积为400mL,再次测定pH;取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照;
乙同学:A点说明碳酸氢钠分解,残留率为63.09%,可知白色固体为碳酸氢钠(NaHCO3),
B点残留率为80%,设原固体100g,则B点残留固体为80g,设生成碳酸钠为x,则
2NaHCO3
| ||
106 62
x 100g-80g
| 106 |
| x |
| 62 |
| 100g-80g |
n(NaHCO3)=
| 80g-34.2g |
| 84g/mol |
n(Na2CO3)=
| 34.2g |
| 106g/mol |
故答案为:1.7.
点评:本题考查化学实验方案的评价,涉及物质的性质,盐类水解、化学平衡、差量法计算、图象分析较等,综合性较强,(3)为解答的难点,题目难度较大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
新房子装修使用的木工板、胶合板等材料常会释放出一种具刺激性气味的气体,该气体是( )
| A、甲烷 | B、氨气 |
| C、甲醛 | D、二氧化硫 |
下列说法正确的是( )
| A、草木灰可用作钾肥 |
| B、各种无磷洗衣粉都是天然洗涤用品 |
| C、天然农药是无毒的,合成农药是有毒的 |
| D、植物生长调节剂和杀虫剂对农作物的作用相同 |




 已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系:
已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系: