题目内容
浓H2SO4在加热的条件下,可以和Cu等不活泼金属反应,释放出SO2气体,是因为浓H2SO4具有( )
| A、吸水性 | B、脱水性 |
| C、强氧化性 | D、强酸性 |
考点:浓硫酸的性质
专题:氧族元素
分析:铜和浓硫酸发生反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,该反应中S元素化合价由+6价变为+4价、Cu元素化合价由0价变为+2价,据此分析解答.
| ||
解答:
解:铜和浓硫酸发生反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,该反应中S元素化合价由+6价变为+4价、Cu元素化合价由0价变为+2价,该反应中浓硫酸作氧化剂、Cu作还原剂,所以浓硫酸体现强氧化性,故选C.
| ||
点评:本题考查了浓硫酸的性质,根据元素化合价变化确定浓硫酸的性质,注意吸水性和脱水性的区别,题目难度不大.

练习册系列答案
相关题目
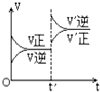 对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
已知合成氨反应N2+3H2?2NH3的浓度数据如下:
当用氢气浓度的减少来表示该化学反应速率时,其速率[mol/(L?s)]为( )
| N2 | H2 | NH3 | |
| ′起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末mol/L | 0.6 | 1.8 | 0.8 |
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
下列叙述正确的是( )
| A、离子化合物中必须含有金属阳离子 |
| B、物质中化学键被破坏,则一定发生化学变化 |
| C、NaCl的结构式为Na-Cl |
| D、H2O的沸点高于H2S |
设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、标准状况下,22.4L氦气所含原子数为NA | ||
| B、2.3g金属钠变为钠离子时失去的电子数为0.1NA | ||
| C、常温常压下,44g CO2的质子数为15NA | ||
D、标准状况下,a L的氧气和氮气的混合物含有的分子数约为
|
下列说法中,正确的是( )
| A、Na2O2的摩尔质量为78g |
| B、标准状况下,22.4LH2O的物质的量为1mol |
| C、同温、同压下,CO2的密度是H2密度的22倍 |
| D、1molHCl通入1L水中,所得盐酸的物质的量浓度为1mol?L-1 |
 在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2?2SO3
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2?2SO3