题目内容
15.下列说法中正确的是( )| A. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| B. | HCl中存在离子键,属于离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
分析 A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
B.只含共价键的化合物是共价化合物,共价化合物中一定不含离子键;
C.含有共价键的化合物可能是离子化合物;
D.阴阳离子之间通过静电作用形成的化学键为离子键.
解答 解:A.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,属于离子化合物,故A正确;
B.HCl分子中H-Cl原子之间只存在共价键,属于共价化合物,故B错误;
C.含有共价键的化合物可能是离子化合物,如铵盐等,故C错误;
D.阴阳离子之间通过静电作用形成的化学键为离子键,静电作用包含吸引力和排斥力,故D错误;
故选A.
点评 本题考查离子化合物和共价化合物、离子键、共价键的判断,侧重考查基本概念,注意不能根据是否含有金属元素判断离子化合物,要根据物质构成微粒判断,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
5.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LSO3所含电子数约为40NA | |
| B. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| C. | 48gO2,O3混合气体含有的氧原子数为3NA | |
| D. | 1molCl2作为氧化剂得到的电子数一定为NA |
6.若发现了116号元素,并知它是第ⅥA族元素,则下列说法中不正确的是( )
| A. | 其钠盐的化学式为Na2X | B. | 最高价氧化物对应水化物为碱 | ||
| C. | X是金属元素 | D. | X单质是能导电的固体 |
3.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中化学键类型完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | M的气态氢化物比N的气态氢化物稳定 |
20.氢化铵(NH4H)与氯化铵的结构相似,它与水反应有气体生成.下列关于氢化铵叙述不正确的是( )
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是 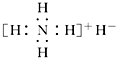 | |
| C. | 与水反应时,它既是还原剂又是氧化剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
7.现对卤素单质Cl2,Br2,I2的氧化性强弱进行探究,从而总结出在元素周期表中,同一主族元素非金属性变化规律.完成下列表格并得出结论
结论:(1)卤素单质Cl2,Br2,I2的氧化性由强到弱的顺序Cl2>Br2>I2
(2)同一主族元素从上到下非金属性逐渐减弱.
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
(2)同一主族元素从上到下非金属性逐渐减弱.
14.下列工业生产过程中涉及到反应热再利用的是( )
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
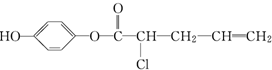 ,其不可能发生的反应有( )
,其不可能发生的反应有( )