题目内容
18.下列物质的稀水溶液中,除水分子外,不存在其它分子的是( )| A. | NH3 | B. | CH3COOH | C. | HNO3 | D. | HClO |
分析 A.NH3溶于水会生成弱电解质一水合氨;
B.醋酸部分电离;
C.硝酸为强电解质,氢离子和硝酸根离子不水解;
D.HClO为弱电解质,在溶液中存在分子.
解答 解:A.NH3溶于水会生成弱电解质一水合氨分子,故A错误;
B.醋酸是弱电解质存在电离平衡,溶液中存在醋酸分子,故B错误;
C.硝酸为强电解质,在水溶液中完全电离,电离出氢离子和硝酸根离子,氢离子和硝酸根离子不水解,除水分子外,不存在其它分子,故C正确;
D.HClO为弱电解质,在溶液中部分电离,除水分子外,存在HClO分子,故D错误;
故选C.
点评 本题考查了弱电解质的概念,明确弱电解质的性质是解答本题的关键,平时注意基础知识的积累,题目难度不大.

练习册系列答案
相关题目
6.某研究小组利用硫铁矿烧渣(主要成分是Fe2O3,还有少量的FeO、Fe3O4、Al2O3、SiO2等杂质)制备FeSO4•7H2O晶体的流程如图:
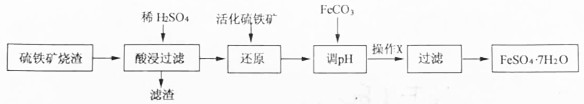
已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
请回答下列问题:(1)酸浸时主要反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,滤渣的主要成分是SiO2
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.

已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.
3.在l01kPa时燃烧1t含FeS2质量分数为70%的黄铁矿(杂质不参加反应)生成固态Fe2O3和气 态SO2,放出4.98×106kJ的热量.表示上述反应的热化学方程式正确的是( )
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
10.下列说法正确的是( )
| A. | 等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | 植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程 | |
| C. | 在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| D. | 热化学方程式中的△H的值与反应物的用量有关 |
7.下列溶液一定呈中性的是( )
| A. | c(H+)=1×10-7 mol/L | B. | c(OH-)=1×10-7mol/L | ||
| C. | c(H+)=c(OH-) | D. | pH=7 |
8.配制2mol/L的NaOH的溶液90mL,应选用的容量瓶型号及称取的NaOH固体的质量分别为( )
| A. | 90mL容量瓶,7.2g | B. | 100mL容量瓶,8.0g | ||
| C. | 100mL容量瓶,7.2g | D. | 250mL容量瓶,20.0g |
 在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:
在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题: