题目内容
19.化学与生产、生活及社会可持续发展密切相关.下列说法不正确的是( )| A. | 将地沟油回收加工成燃料,可提高资源的利用率 | |
| B. | 把蔬菜或海产品用福尔马林浸泡,可保鲜并消毒 | |
| C. | 推广使用聚碳酸酯等可降解塑料,可减少白色污染 | |
| D. | 化石燃料的蕴藏量有限且不可再生,最终将会枯竭 |
分析 A.地沟油对人体有害,将地沟油回收加工成燃料,可充分利用资源;
B.福尔马林对人体有害;
C.聚碳酸酯可降解;
D.化石燃料不可再生.
解答 解:A.地沟油对人体有害,将地沟油回收加工成燃料,可充分利用资源,故A正确;
B.福尔马林对人体有害,不能用于食品的浸泡,故B错误;
C.聚碳酸酯可降解,可减少污染,故C正确;
D.天然气、煤、石油属于化石燃料.在我国能源领域占有重要的地位.化石燃料燃烧无论充分燃烧还是不充分燃烧都会对环境产生影响,且储量有限,是一种有局限性的能源,故D正确.
故选B.
点评 本题综合考查化学环境的污染与保护,侧重于化学与生活、环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| B. | 2mol/L的硫酸溶液中含有的H+离子数为4NA | |
| C. | 1mol 氯气与足量的铁反应后转移的电子数为3NA | |
| D. | 密闭容器中1molN2与3molH2在铂催化下充分反应,产物的分子数为2NA |
7.2015年2月朝鲜准备进行${\;}_{92}^{235}U$第四次核试验,引起国际社会的极大关注.是一种重要的核燃料,这里的“235”是指该原子的( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
14.下列离子方程式正确的是( )
| A. | 钠投入到水中 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氯化铵溶液与浓NaOH溶液加热 NH4++OH-═NH3•H2O | |
| C. | 氯化铝溶液中滴入过量氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁片插入氯化铁溶液中 Fe+Fe3+═2Fe2+ |
11.下列反应中,属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Ca(ClO)2+2HCl═CaCl2+2HClO |
3.描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
表1
表2
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是HCN(用化学式表示).下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是B(填序号).
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”或“碱性”),溶液中各离子浓度大小关系是c(NH4+)=c(CH3COO-)>c(OH-)=c(H+).
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中电荷守恒等式为c(Na+)+c(H+)=c(CN-)+c(OH-).
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2).具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3.现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L-1,则溶液中CO32-物质的量浓度应≥0.26mol•L-1.
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
(1)表1所给的四种酸中,酸性最弱的是HCN(用化学式表示).下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是B(填序号).
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”或“碱性”),溶液中各离子浓度大小关系是c(NH4+)=c(CH3COO-)>c(OH-)=c(H+).
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中电荷守恒等式为c(Na+)+c(H+)=c(CN-)+c(OH-).
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2).具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3.现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L-1,则溶液中CO32-物质的量浓度应≥0.26mol•L-1.




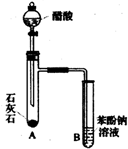 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.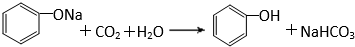 .
. 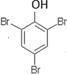 .
.
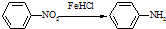 (苯胺,易被氧化)
(苯胺,易被氧化)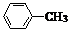 .
.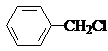 .
.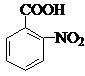 .反应②③两步能否互换不能,(填“能”或“不能”)理
.反应②③两步能否互换不能,(填“能”或“不能”)理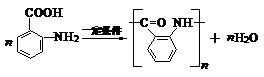 ;反应⑤的化学方程式是
;反应⑤的化学方程式是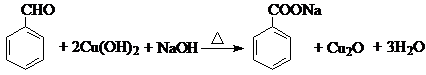 .
.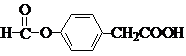 .
.