题目内容
科学家认为,氢气是一种高效而无污染的理想能源.
(1)4克H2完全燃烧生成液态水时放出571.6kJ的热量,请写出表示H2燃烧热的热化学方程式: .
(2)阿波罗号宇宙飞船上使用的电池是氢氧燃料电池,其电池反应为:2H2+O2═2H2O,电解质溶液为H2SO4溶液.写出正极的电极反应式: ;电池工作时,电解质溶液的pH不断 (填增大、减小或不变)
(3)近年来已经研制出甲醇燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式: .
(1)4克H2完全燃烧生成液态水时放出571.6kJ的热量,请写出表示H2燃烧热的热化学方程式:
(2)阿波罗号宇宙飞船上使用的电池是氢氧燃料电池,其电池反应为:2H2+O2═2H2O,电解质溶液为H2SO4溶液.写出正极的电极反应式:
(3)近年来已经研制出甲醇燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:
考点:热化学方程式,化学电源新型电池
专题:化学反应中的能量变化
分析:(1)根据n=
计算氢气的物质的量结合燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量解答;
(2)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式,根据溶液中氢离子浓度的变化判断溶液PH值的变化;
(3)甲醇燃料电池中,甲醇从负极通入,在反应中失电子被氧化,碱性条件下生成碳酸根离子和水.
| m |
| M |
(2)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式,根据溶液中氢离子浓度的变化判断溶液PH值的变化;
(3)甲醇燃料电池中,甲醇从负极通入,在反应中失电子被氧化,碱性条件下生成碳酸根离子和水.
解答:
解:(1)4克H2的物质的量为n=
=
=2mol,生成液态水时放出571.6kJ的热量,燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量,所以H2燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O (1)△H=-285.8 kJ?mol-1,
故答案为:H2(g)+
O2(g)=H2O (1)△H=-285.8 kJ?mol-1;
(2)氢氧燃料电池是将化学能转化为电能的装置,该反应在酸性环境中,负极上氢气失电子被氧化,氢气失电子生成氢离子,正极上氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以正极上电极反应式为O2+4H++4e-═2H2O;
随着反应的进行,生成的水越来越多,溶质硫酸的量不变,所以导致溶液的浓度降低,所以溶液的PH值增大;
故答案为:O2+4H++4e-═2H2O;增大;
(3)在甲醇燃料电池中,负极上是燃料甲醇发生失电子的氧化反应,在碱性环境下,电极反应为:CH3OH+8OH--6e-═CO32-+6H2O;
故答案为:CH3OH+8OH--6e-═CO32-+6H2O.
| m |
| M |
| 4g |
| 2g/mol |
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)氢氧燃料电池是将化学能转化为电能的装置,该反应在酸性环境中,负极上氢气失电子被氧化,氢气失电子生成氢离子,正极上氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以正极上电极反应式为O2+4H++4e-═2H2O;
随着反应的进行,生成的水越来越多,溶质硫酸的量不变,所以导致溶液的浓度降低,所以溶液的PH值增大;
故答案为:O2+4H++4e-═2H2O;增大;
(3)在甲醇燃料电池中,负极上是燃料甲醇发生失电子的氧化反应,在碱性环境下,电极反应为:CH3OH+8OH--6e-═CO32-+6H2O;
故答案为:CH3OH+8OH--6e-═CO32-+6H2O.
点评:本题考查了H2燃烧热的热化学方程式书写、原电池原理的应用,主要考查了燃料电池的电极方程式的书写,题目难度不大,注意电解质溶液的酸碱性对电极方程式的影响.

练习册系列答案
相关题目
下列关于原电池的叙述正确的是( )
| A、构成原电池的正极和负极必须是两种不同的金属 |
| B、原电池是将化学能转变为电能的装置 |
| C、原电池中电子流出的一极是负极,该极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
下列关于同系物的说法正确的是( )
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、具有相同通式的有机物一定互为同系物 |
| C、两个相邻同系物的相对分子质量数值一定相差12 |
| D、分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
对如图所示分子的描述不正确的是( )
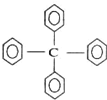

| A、该物质的分子式为C25H20 |
| B、该物质所有氢原子不可能在同一平面上 |
| C、该物质属于烷烃 |
| D、该物质的一氯代物有3种 |
下列气体中,可溶于水的无色气体是( )
| A、N2 |
| B、NO |
| C、NO2 |
| D、NH3 |
在污染环境的有害气体中,主要由于跟血红蛋白结合而引起中毒的有毒气体是( )
| A、SO2 |
| B、CO2 |
| C、NO2 |
| D、CO |
在0℃和1×105Pa 下,用铂电极电解硫酸铜溶液,当阴极产生6.4g铜时,阳极放出( )
| A、1.12 L氢气 |
| B、1.12 L氧气 |
| C、2.24 L氢气 |
| D、2.24 L氧气 |
被誉为“光纤之父”的科学家高锟荣获2009年诺贝尔化学奖.下列叙述不正确的是( )
| A、SiO2是生产光导纤维和粗硅的主要原料 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、SiO2与CO2都属于酸性氧化物,都不能与酸反应 |
| D、水晶的主要成分是SiO2 |