题目内容
20.下列过程中△H小于零的是( )| A. | 石灰石高温分解 | B. | 铝与盐酸的反应 | ||
| C. | 二氧化碳与碳反应 | D. | 氢氧化钡晶体与氯化铵反应 |
分析 △H小于零表示该反应为放热反应.常见的放热反应有:所有的物质燃烧反应、所有金属与酸的反应、常温下,金属和水的反应、所有的中和反应、绝大多数的化合反应、置换反应、少数分解、复分解反应等.
解答 解:A.石灰石高温分解,是分解反应,是吸热反应,故A错误;
B.铝与盐酸的反应,是放热反应,故B正确;
C.二氧化碳与碳反应,是吸热反应,故C错误;
D.氢氧化钡晶体与氯化铵反应是吸热反应,故D错误;
故选B.
点评 本题考查化学反应的热量变化,一是须理解△H小于零是放热,大于零是吸热,平时学习应注重归纳中学化学中常见的吸热或放热的反应.

练习册系列答案
相关题目
10.常温下,下列各组离子或分子在指定溶液中一定能大量共存的是( )
| A. | 加入KSCN变红的溶液中:Na+、Al3+、Cl-、S2- | |
| B. | 1.0 mol?L-1的Na2CO3的溶液中:NH4+、SO32-、Cl-、SO2 | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
8.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
则下列热化学方程式不正确的是( )
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ•mol-1 | 243kJ•mol-1 | 431kJ•mol-1 |
| A. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2(g)═AB(g)△H=-91.5 kJ•mol -1 | |
| B. | A2(g)+B2(g)═2AB(g)△H=-183 kJ•mol -1 | |
| C. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2═AB(g)△H=+91.5 kJ•mol-1 | |
| D. | 2AB(g)═A2(g)+B2(g)△H=+183 kJ•mol-1 |
9.取两份质量相同的小苏打,一份直接与稀盐酸反应,另一份先加热至恒重,再与稀盐酸反应,下列说法正确的是( )
| A. | 消耗相同浓度的盐酸一样多 | |
| B. | 消耗同浓度的盐酸后者多 | |
| C. | 与盐酸反应后相同条件下收集的气体一样多(不包括加热生成的) | |
| D. | 与盐酸反应后相同条件下收集的气体后者多.(不包括加热生成的) |

 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 .
. .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH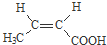 .
. .
.