题目内容
20.根据元素周期表和元素周期律分析下面的判断,其中正确的是( )| A. | 钠原子失电子能力比镁弱 | B. | 水比硫化氢稳定 | ||
| C. | 硅酸比磷酸酸性强 | D. | 氢氧化钙比氢氧化锶碱性强 |
分析 A.同周期从左向右金属性减弱;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.金属性越强,对应碱的碱性越强.
解答 解:A.同周期从左向右金属性减弱,则钠原子失电子能力比镁强,故A错误;
B.非金属性O大于S,则水比硫化氢稳定,故B正确;
C.非金属性P大于Si,硅酸比磷酸酸性弱,故C错误;
D.金属性Ca<Sr,氢氧化钙比氢氧化锶碱性弱,故D错误;
故选B.
点评 本题考查元素周期律和元素周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.可逆反应N2+3H2?2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到最大限度(即化学平衡)的是( )
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
15.与OH-具有相同的质子数和电子数的微粒是( )
| A. | F- | B. | Cl- | C. | Na+ | D. | NH2- |
12.下列参数比较及解释均正确的是( )
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
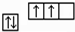 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
 ;该反应的类型为取代.
;该反应的类型为取代.
