题目内容
16.铝是大自然赐予人类的宝物.它其中的一个用途是作为铝热剂,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,还原产物是Fe,氧化剂是Fe2O3,若有0.3mol的电子发生转移,则有5.6g的铁生成.分析 反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应中Al元素化合价由0价升高为+3价,Fe元素化合价由+3价降低到0价,以此解答该题.
解答 解:反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应中Al元素化合价由0价升高为+3价,Fe元素化合价由+3价降低到0价,则氧化剂为Fe2O3,还原产物为Fe,若有0.3mol的电子发生转移,则生成0.1molFe,质量为0.1mol×56g/mol=5.6g.
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;Fe;Fe2O3;5.6.
点评 本题考查氧化还原反应以及铝热反应,为高频考点,侧重考查学生的分析能力、计算能力,注意把握物质的性质以及元素化合价的变化,难度不大.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
14.下列反应的离子方程式不正确的是( )
| A. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铁丝与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
7.(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质.某课题小组为了探究莫尔盐的分解产物,开展了如下实验:

(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2•6H2O分解的部分产物.装置A的气密性的检查方法是将装置A与导管相连,将该导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀.观察插入水中的导管是否有气泡.停止微热后,导管是否出现水柱.
已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量.
①B装置的作用是除去NH3.
②M干燥管中所放的药品是碱石灰.
(2)检验(NH4)2Fe(SO4)2•6H2O是否变质的试剂是KSCN(填化学式);检验是否完全变质的实验方法是取少量样品于试管中,加入适量蒸馏水,振荡充分溶解,再滴加酸性高锰酸钾溶液,若紫色溶液变浅,则说明样品未完全变质;若紫色溶液不变色,说明样品已完全变质.
(3)实验室常用(NH4)2Fe(SO4)2•6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O82-+2Fe2+═2Fe3++2SO42-).取w g过二硫酸铵样品溶于蒸馏水配制成250mL 溶液.准确量取20,.00mL配制的溶液于锥形瓶中,用c mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
①完成上述实验需要准确量取20.00mL过二硫酸铵溶液,所用仪器的名称是酸式滴定管或移液管.
②根据上述数据计算,样品的纯度为$\frac{c×20×1{0}^{-3}×\frac{1}{2}÷\frac{250}{20}×238}{W}$×100%(用含w、c的代数式表示).

(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2•6H2O分解的部分产物.装置A的气密性的检查方法是将装置A与导管相连,将该导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀.观察插入水中的导管是否有气泡.停止微热后,导管是否出现水柱.
已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量.
①B装置的作用是除去NH3.
②M干燥管中所放的药品是碱石灰.
(2)检验(NH4)2Fe(SO4)2•6H2O是否变质的试剂是KSCN(填化学式);检验是否完全变质的实验方法是取少量样品于试管中,加入适量蒸馏水,振荡充分溶解,再滴加酸性高锰酸钾溶液,若紫色溶液变浅,则说明样品未完全变质;若紫色溶液不变色,说明样品已完全变质.
(3)实验室常用(NH4)2Fe(SO4)2•6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O82-+2Fe2+═2Fe3++2SO42-).取w g过二硫酸铵样品溶于蒸馏水配制成250mL 溶液.准确量取20,.00mL配制的溶液于锥形瓶中,用c mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②根据上述数据计算,样品的纯度为$\frac{c×20×1{0}^{-3}×\frac{1}{2}÷\frac{250}{20}×238}{W}$×100%(用含w、c的代数式表示).
4.可用如图所示装置制取(必要时可加热)、净化、收集的气体是( )


| A. | 亚硫酸钠固体与硫酸反应制二氧化硫 | |
| B. | 铜与稀硝酸反应制一氧化氮 | |
| C. | 氯化铵与氢氧化钙固体反应制氨气 | |
| D. | 锌和稀硫酸反应制氢气 |
11.下列叙述正确的是( )
| A. | 短周期元素是指1~20号元素 | |
| B. | 核素的种类和元素的种类一样多 | |
| C. | 元素周期表中共有18列、16个族 | |
| D. | 主族元素的最高正价均等于其族序数 |
1.下列分离或提纯物质的方法正确的是( )
| A. | 用分馏石油的方法可获取汽油 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用蒸发、结晶、灼烧的方法从硫酸铜溶液中获取胆矾(CuSO4?5H2O) | |
| D. | 用溶解、过滤的方法除去KNO3中的KC1 |
8.下列有关物质性质、用途的说法都正确的是( )
| A. | 硅晶体是良好的半导体,可用于制造光导纤维 | |
| B. | 高压钠灯发出的黄光透雾能力强,可用于道路和广场照明 | |
| C. | 生石灰能与水反应,可用于除去HC1气体中少量的水蒸气 | |
| D. | 氢氧化钠具有强碱性,可用于制胃酸中和剂 |
5.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
6.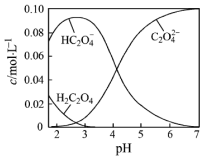 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |