题目内容
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.工业设计生产NaClO2的主要流程如下.
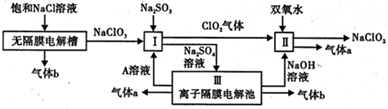
(1)在无隔膜电解槽中持续电解发生反应的氧化剂为 (填化学式).
(2)Ⅲ中产生气体a的电极反应式为 .
(3)Ⅱ中产生气体a的电极反应式为 .
(4)①在碱性溶液中NaClO2比较稳定,所以Ⅱ中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是 .
②工业上Ⅱ中制备NaClO2为防止被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是 (填序号)
A.Na2O2 B.Na2S C.FeCl2 D.PbO(悬浊液)
(5)ClO2是一种高效水处理剂,ClO2将对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式为 ;处理100m3这种污水,至少需要ClO2 mol.

(1)在无隔膜电解槽中持续电解发生反应的氧化剂为
(2)Ⅲ中产生气体a的电极反应式为
(3)Ⅱ中产生气体a的电极反应式为
(4)①在碱性溶液中NaClO2比较稳定,所以Ⅱ中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是
②工业上Ⅱ中制备NaClO2为防止被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是
A.Na2O2 B.Na2S C.FeCl2 D.PbO(悬浊液)
(5)ClO2是一种高效水处理剂,ClO2将对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)电解氯化钠溶液,在阴极上是水中的氢离子得电子的还原反应;
(2)III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上生成O2+,阴极产生H2;
(3)电解池中,阳极上发生氧化反应,根据产物来确定发生的反应;
(4)①NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH;
②还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2.
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;根据方程式计算需要ClO2的物质的量.
(2)III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上生成O2+,阴极产生H2;
(3)电解池中,阳极上发生氧化反应,根据产物来确定发生的反应;
(4)①NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH;
②还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2.
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;根据方程式计算需要ClO2的物质的量.
解答:
解:(1)电解氯化钠溶液,在阴极上是水中的氢离子得电子的还原反应,所以水是氧化剂,故答案为:H2O;
(2)III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为2H2O+2e-=H2↑+2OH-,左边流出硫酸,所以A气体是氧气,B气体是氢气、生成氧气的电极反应式为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(3))Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,若电解原理来实现转化.则阳极上生成氧气的反应为:2OH-+H2O2-2e-=2H2O+O2↑,
故答案为:2OH-+H2O2-2e-=2H2O+O2↑;
(4)①NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH.
故答案为:连续测定吸收塔内溶液的pH.
②还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,不会影响后续生产,但是Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,PbO(悬浊液)
氧化性较差,不合适,
故选:A.
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为
=
mol,由方程式可知,至少需要ClO2的物质的量=
mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;
mol.
(2)III中电解质是Na2SO4,电解Na2SO4溶液时,阳极上电极反应式为2H2O-4e-=O2↑+4H+、阴极电极反应式为2H2O+2e-=H2↑+2OH-,左边流出硫酸,所以A气体是氧气,B气体是氢气、生成氧气的电极反应式为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(3))Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,若电解原理来实现转化.则阳极上生成氧气的反应为:2OH-+H2O2-2e-=2H2O+O2↑,
故答案为:2OH-+H2O2-2e-=2H2O+O2↑;
(4)①NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH.
故答案为:连续测定吸收塔内溶液的pH.
②还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,不会影响后续生产,但是Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,PbO(悬浊液)
氧化性较差,不合适,
故选:A.
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为
| 100ag |
| 26g/mol |
| 50a |
| 13 |
| 50a |
| 13 |
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;
| 50a |
| 13 |
点评:本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
在下列溶液中,能大量共存的离子组是( )
| A、能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- | ||
B、常温下
| ||
| C、含有大量Fe3+的溶液中:SO42-、S2-、AlO2-、ClO- | ||
| D、能使石蕊试液显红色的溶液中:K+、SO42-、CH3COO-、PO43- |
下列溶液中有关物质的量浓度关系不正确的( )
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1 mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系.
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系.说明:AlO2-即[Al(OH)4]-下列有关叙述正确的是( )
| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:整个阶段Ba2+一定不会等于OH- |
下列物质能由单质直接化合而成,但不能由单质和盐酸反应生成的是( )
| A、FeCl2 |
| B、CuCl2 |
| C、AlCl3 |
| D、NaCl |
