题目内容
8.下列属于电解质的是( )| A. | 石墨 | B. | 铁丝 | C. | 醋酸 | D. | 盐酸 |
分析 水溶液中或熔融状态下导电的化合物为电解质,水溶液中和熔融状态下都不导电的化合物为非电解质,单质和混合物既不是电解质也不是非电解质.
解答 解:A.石墨是单质既不是电解质也不是非电解质,故A错误;
B.铁丝是单质既不是电解质也不是非电解质,故B错误;
C.醋酸溶于水导电属于电解质,故C正确;
D.盐酸是氯化氢气体的水溶液属于混合物,既不是电解质也不是非电解质,故D错误;
故选C.
点评 本题考查了电解质、非电解质的概念分析,注意概念实质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列有关物质应用的说法正确的是( )
| A. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
19.已知一种c(H+)=10-3mol/L的酸和一种c(OH-)=10-3mol/L的碱等体积混合后,溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱反应 | B. | 浓的弱酸和稀的强碱反应 | ||
| C. | 等浓度的强酸和弱碱反应 | D. | 二元强酸与一元强碱反应 |
16.25℃时,相同物质的量浓度的下列溶液:①NaCl ②NaOH ③H2SO4其中水的电离程度按由大到小顺序排列的一组是( )
| A. | ③>②>① | B. | ②>③>① | C. | ①>②>③ | D. | ③>①>② |
3.常温时,用0.01mol/L H2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL,若滴定时终点判断有误差:①多加1滴HH2SO4②少加1滴H2SO4 (设1滴为0.05mL)则①和②H+浓度的比值是( )
| A. | 10 | B. | 50 | C. | 5×l03 | D. | 104 |
13.下列说法正确的是( )
| A. | ${\;}_{17}^{37}$Cl表示质子数为17、中子数为20的核素 | |
| B. | 乙二醇(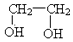 )和甘油( )和甘油(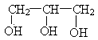 )互为同系物 )互为同系物 | |
| C. | 干冰和CO2互为同分异构体 | |
| D. | 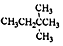 的名称是3,3-二甲基丁烷 的名称是3,3-二甲基丁烷 |
20.已知氧化性Fe3+>I2,在含有nmolFeI2的溶液中通入Cl2,有x mol Cl2发生反应.下列说法正确的是( )
| A. | 当x≤n时,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 当x≥$\frac{3n}{2}$时,反应的离子方程式为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 当n≤x≤$\frac{3n}{2}$时,反应中转移电子的物质的量n(e-)为2nmol≤n(e-)≤3nmol | |
| D. | 当n<x<$\frac{3n}{2}$时,溶液中Fe3+、Cl-、I2的物质的量之比为2(x-n):x:n |
17.下列说法正确的是( )
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 花生油、石油、羊油和牛油均属于高级脂肪酸甘油酯 | |
| C. | 煤在空气中经过高温强热制得焦炭、苯等化工原料 | |
| D. | 汽油、柴油通常作为汽车的燃料,是一种清洁的燃料 |
19.X、Y、Z、W是短周期元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | Y的阳离子半径比W的阴离子半径小 | |
| C. | X、Z、W最高价氧化物对应水化物酸性的强弱顺序为X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液其pH<7 |