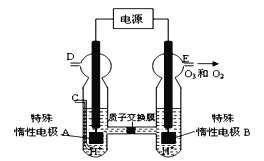
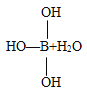
题目内容
【题目】某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)提取前将铝土矿“粉碎”目的是__________。
(2)固体B的主要用途有________________(写出一条即可)。
(3)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式有: _____________(至少写一个)。
(4)第②步中加入过量盐酸的目的是____________________;实验室配制200mL 8mol/L的盐酸需要的玻璃仪器有__________________。
(5)能否把第③步中的氨水换成氢氧化钠__________,理由___________。
【答案】加快固体溶解速率、提高浸出率等 炼铁原料、用作涂料、油漆等 ![]() 、
、![]() 防止氢氧化铝溶解不完全 量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管 不能 因氢氧化铝能够与强碱发生反应,难以控制氢氧化钠溶液的量,可能造成产品损失或原料利用不充分
防止氢氧化铝溶解不完全 量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管 不能 因氢氧化铝能够与强碱发生反应,难以控制氢氧化钠溶液的量,可能造成产品损失或原料利用不充分
【解析】
向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱,Fe2O3不溶于碱,SiO2溶于强碱,则在①得到溶液A中含有偏铝酸根离子、硅酸根离子、钠离子、氢氧根离子,固体B为氧化铁;向溶液A中加入盐酸,将硅酸根离子转化为难溶物硅酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入溶液D;然后向溶液D中加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,以此解答。
(1)提取前将铝土矿“粉碎”目的是:加快固体溶解速率、提高浸出率等;
(2)固体B为Fe2O3,Fe2O3可作为炼铁的原料,氧化铁为红色,可用作涂料、油漆等;
(3)由上述分析可知,该过程中反应离子方程式为:![]() 、
、![]() ;
;
(4)第②步中加入盐酸,盐酸与先与氢氧化钠反应,然后与硅酸钠、偏铝酸钠反应,生成的硅酸和氢氧化铝均为难溶物,最后盐酸与氢氧化铝反应生成氯化铝,为防止氢氧化铝溶解不完全,因此加入的盐酸需过量;实验室配制200mL 8mol/L的盐酸采用浓溶液稀释配制,需要玻璃仪器为:量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管;
(5)因氢氧化铝能够与强碱发生反应,而与弱碱不发生反应,因此一般采用氨水与氯化铝反应制备氢氧化铝,若采用氢氧化钠溶液,难以控制氢氧化钠溶液的量,可能造成产品损失或原料利用不充分。

【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D