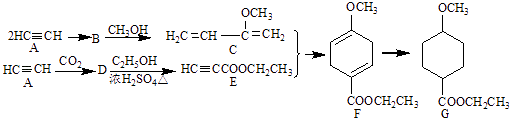��Ŀ����
����Ŀ��ͭ��һ����Ҫ����ɫ��������������;Խ��Խ�㷺����ش��������⣺
��1���������ֻ������к�ͭ����ߵ���������ĸ��
A.Cu5FeS4
B.CuFeS2
C.Cu2S
D.Cu2��OH��2CO3
��2��2014���ҹ�����ͭ����796��֣���ȫ���ɺ�Cu2S��������Ϊ32%��ͭ��ʯұ���õ�������Ҫͭ��ʯ����Ϊ��֣�������һλС����
��3��������ͭ�γ���������������ͭ�������KOH��Һ�м���һ������CuSO4��Һ���ټ���һ�����Ļ�ԭ�������£�N2H4�������Ȳ������¶���90�棬����һ�ֶԻ�������Ⱦ�����壬��Ӧ��ȫ���룬ϴ�ӣ���ո���õ�����������ͭ���壨Cu2O�����ٸ��Ʊ����̵ķ�Ӧ����ʽΪ ��
�ڹ�ҵ�ϳ��õĹ�Һ�����豸��������ĸ��
A�����Ļ� B�������� C����ʽѹ�˻� D����Ӧ��
��4���ҹ���������ͭ�����վ�տ�����кܸߵ�������ֵ����ʷ��ֵ������������ͭ������ܵ�������ʴ����ͼ����ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ��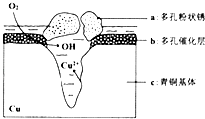
�ٸ�ʴ�����У����������a����b����c������������Ӧ����ʽΪ ��
�ڻ����е�Cl����ɢ���ڣ�����������������������ɶ��״��Cu2��OH��3Cl�������ӷ���ʽΪ ��
���𰸡�
��1��C
��2��3109.4
��3��4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2��+4K2SO4+6H2O��AC
2Cu2O+N2��+4K2SO4+6H2O��AC
��4��c��O2+2H2O+4e���T4OH����2Cu2++3OH��+Cl��=Cu2��OH��3Cl��
���������⣺��1��A��Cu5FeS4�к�ͭ��Ϊ ![]() =0.63�� B��CuFeS2�к�ͭ��Ϊ
=0.63�� B��CuFeS2�к�ͭ��Ϊ ![]() =0.35�� C��ͭ��Ϊ
=0.35�� C��ͭ��Ϊ ![]() =0.8�� D��Cu2��OH��2CO3�к�ͭ��Ϊ
=0.8�� D��Cu2��OH��2CO3�к�ͭ��Ϊ ![]() =0.58�����Դ��ǣ�C����2��Cu2S��ͭԪ�ص���������=
=0.58�����Դ��ǣ�C����2��Cu2S��ͭԪ�ص���������= ![]() ��100%=80%����X�ֺ�Cu2S 32%��ͭ��ʯ�к�ͭԪ������=Xt��80%��32%=796��t�����X=3109.4��֣����Դ��ǣ�3109.4����3�����������֪��������������ͭ��N2H4����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ4CuSO4+N2H4+8KOH
��100%=80%����X�ֺ�Cu2S 32%��ͭ��ʯ�к�ͭԪ������=Xt��80%��32%=796��t�����X=3109.4��֣����Դ��ǣ�3109.4����3�����������֪��������������ͭ��N2H4����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2��+4K2SO4+6H2O�����Դ��ǣ�4CuSO4+N2H4+8KOH
2Cu2O+N2��+4K2SO4+6H2O�����Դ��ǣ�4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2��+4K2SO4+6H2O���ڹ�ҵ�ϳ��õĹ�Һ�����豸�����Ļ��Ϳ�ʽѹ�˻������Դ��ǣ�AC����4���ٸ���ͼ֪�������õ����������������ӡ�Cuʧ��������ͭ���ӣ�����������ʴ����Cu����������c�Ǹ���������������ԭ��Ӧ���缫����ʽΪO2+2H2O+4e���T4OH�� �� ���Դ��ǣ�c����Cl����ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��״��Cu2��OH��3Cl������������ͭ���ӡ��������������������ӣ����Ը����ӷ�ӦΪ�����ӡ�ͭ���Ӻ����������ӷ�Ӧ����Cu2��OH��3Cl���������ӷ���ʽΪ2Cu2++3OH��+Cl��=Cu2��OH��3Cl�������Դ��ǣ�2Cu2++3OH��+Cl��=Cu2��OH��3Cl����
2Cu2O+N2��+4K2SO4+6H2O���ڹ�ҵ�ϳ��õĹ�Һ�����豸�����Ļ��Ϳ�ʽѹ�˻������Դ��ǣ�AC����4���ٸ���ͼ֪�������õ����������������ӡ�Cuʧ��������ͭ���ӣ�����������ʴ����Cu����������c�Ǹ���������������ԭ��Ӧ���缫����ʽΪO2+2H2O+4e���T4OH�� �� ���Դ��ǣ�c����Cl����ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��״��Cu2��OH��3Cl������������ͭ���ӡ��������������������ӣ����Ը����ӷ�ӦΪ�����ӡ�ͭ���Ӻ����������ӷ�Ӧ����Cu2��OH��3Cl���������ӷ���ʽΪ2Cu2++3OH��+Cl��=Cu2��OH��3Cl�������Դ��ǣ�2Cu2++3OH��+Cl��=Cu2��OH��3Cl����