题目内容
如图是元素周期表的一部分,其中每个数字编号代表对应的一种元素.请按要求回答下列问题:
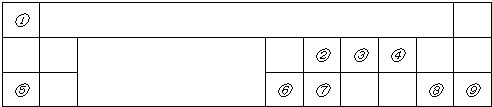
(1)画出元素②的原子结构示意图 .
(2)属于稀有气体的元素编号是 ,可作半导体材料的元素编号是 .
(3)③、⑦两种元素相比较,非金属性强的是 (填元素符号).
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , .

(1)画出元素②的原子结构示意图
(2)属于稀有气体的元素编号是
(3)③、⑦两种元素相比较,非金属性强的是
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是
考点:元素周期律和元素周期表的综合应用
专题:
分析:根据元素在周期表中位置知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl、⑨为Ar.
(1)C原子核外有6个电子,各层电子数为2、8;
(2)Ar为稀有气体元素;Si可作半导体材料;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
(4)Na与O元素可以形成氧化钠、过氧化钠.
(1)C原子核外有6个电子,各层电子数为2、8;
(2)Ar为稀有气体元素;Si可作半导体材料;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
(4)Na与O元素可以形成氧化钠、过氧化钠.
解答:
解:根据元素在周期表中位置知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl、⑨为Ar.
(1)C原子核外有6个电子,各层电子数为2、8,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)⑨Ar为稀有气体元素;⑦Si可作半导体材料,故答案为:⑨;⑦;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>Si,故答案为:N;
(4)Na与O元素可以形成氧化钠、过氧化钠,对应化学式为:Na2O、Na2O2,故答案为:Na2O;Na2O2.
(1)C原子核外有6个电子,各层电子数为2、8,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)⑨Ar为稀有气体元素;⑦Si可作半导体材料,故答案为:⑨;⑦;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>Si,故答案为:N;
(4)Na与O元素可以形成氧化钠、过氧化钠,对应化学式为:Na2O、Na2O2,故答案为:Na2O;Na2O2.
点评:本题考查元素周期表与元素周期律综合应用,侧重对基础知识的巩固,注意整体把握元素周期表的结构,比较基础.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 某兴趣小组用铜片、铝片和番茄(或橘子、白醋)等生活中的材料制作的简易电池如图所示,下列叙述正确的是( )
某兴趣小组用铜片、铝片和番茄(或橘子、白醋)等生活中的材料制作的简易电池如图所示,下列叙述正确的是( )| A、铝电极是该电池的负极 |
| B、电流由铜片通过导线流向铝片 |
| C、一段时间后,铜片质量会变小 |
| D、该电池将电能转化为了化学能 |
下列有关金属的保护方法的说法中正确的是( )
| A、常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止生锈的作用 |
| B、白铁(镀锌铁)镀层破损后,铁皮的腐蚀速度很慢 |
| C、轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极的阳极保护法 |
| D、钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法 |
 Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
Ⅰ.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献. A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示.A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示.A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似.