题目内容
常温时,将10ml PH=a烧碱溶液加水稀释10b倍后,下列说法正确的是( )
| A、溶液中所有的离子浓度均减小,但Kw不变 |
| B、溶液仍然显碱性,其pH值一定为a-b |
| C、向稀释后烧碱溶液加10ml PH=14-a的醋酸溶液混合后,溶液显酸性 |
| D、水的电离程度增大,溶液中由水电离出的C(H+)=1×1014-ab |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.碱溶液稀释时,c(OH-)减小,但c(H+)增大;
B.注意溶液稀释时,pH减小,但大于7;
C.醋酸为弱酸,不能完全电离,pH=14-a的醋酸,溶液中c(H+)等于烧碱的c(OH-);
D.当pH接近7时,由水电离生成的c(H+)=1×10-7mol/L.
B.注意溶液稀释时,pH减小,但大于7;
C.醋酸为弱酸,不能完全电离,pH=14-a的醋酸,溶液中c(H+)等于烧碱的c(OH-);
D.当pH接近7时,由水电离生成的c(H+)=1×10-7mol/L.
解答:
解:A.碱溶液稀释时,c(OH-)减小,由于Kw不变,则c(H+)增大,故A错误;
B.注意溶液稀释时,pH减小,但大于7,所以pH不一定为a-b,故B错误
C.醋酸为弱酸,不能完全电离,pH=14-a的醋酸,溶液中c(H+)等于烧碱的c(OH-),等体积混合后,酸过量,溶液呈酸性,故C正确;
D.当pH接近7时,由水电离生成的c(H+)=1×10-7mol/L,故D错误.
故选C.
B.注意溶液稀释时,pH减小,但大于7,所以pH不一定为a-b,故B错误
C.醋酸为弱酸,不能完全电离,pH=14-a的醋酸,溶液中c(H+)等于烧碱的c(OH-),等体积混合后,酸过量,溶液呈酸性,故C正确;
D.当pH接近7时,由水电离生成的c(H+)=1×10-7mol/L,故D错误.
故选C.
点评:本题考查酸碱混合及碱溶液稀释的定性分析,把握弱电解质在水溶液中存在电离平衡及稀释时强弱电解质pH的变化为解答的关键,注意等pH稀释相同倍数时强电解质变化大,明确电解质稀释时电离平衡移动即可解答,题目难度中等.

练习册系列答案
相关题目
下列分子中各原子都满足8电子稳定结构的化合物( )
| A、CH4 |
| B、CH2=CH2 |
| C、CO2 |
| D、N2 |
下列各数值表示有关元素的原子序数,其中能以共价键相互结合形成稳定化合物的是( )
| A、8与11 | B、9与19 |
| C、2和19 | D、6与8 |
下列叙述与盐类水解无关的是( )
| A、草木灰与磷肥混合使用会降低肥效 |
| B、使用明矾、氯化铁作净水剂 |
| C、碳酸钙加入水中导电性很弱 |
| D、用硫酸铝和小苏打溶液制泡沫灭火器 |
在无色透明的溶液中,能大量共存的是( )
A、Na+、N
| ||||
B、H+、C
| ||||
C、K+、S
| ||||
D、Ba2+、Cl-、K+、S
|
下列有机反应的化学方程式和反应类型均正确的是( )
A、CH4+Cl2
| ||
B、nCH3-CH=CH2
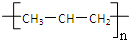 聚合反应 聚合反应 | ||
C、淀粉:(C6H10O5)n+nH2O
| ||
D、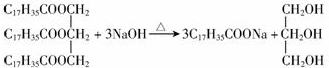 皂化反应 皂化反应 |
下列说法中错误的是( )
| A、能量变化是化学反应的基本特征之一 |
| B、化学反应都伴随着能量变化和其他各种现象的出现 |
| C、拆开物质中的化学键一定需要吸收能量 |
| D、形成化学键的过程一定释放能量 |
下列物质所属的类别正确的是( )
| A、Na2CO3--盐 |
| B、干冰--混合物 |
| C、氢氧化铁胶体--纯净物 |
| D、NaHCO3--酸 |