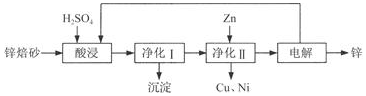
题目内容
1.下列离子方程式书写正确的是( )| A. | 向盐酸中滴入少量偏铝酸钠溶液:AlO2-+H++H2O=Al(OH)3↓ | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
分析 A.偏铝酸钠少量,二者不会生成氢氧化铝沉淀;
B.次氯酸具有强氧化性,能够将亚硫酸根离子氧化硫酸根离子;
C.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
D.过量氨水与二氧化硫反应生成亚硫酸铵.
解答 解:A.向盐酸中滴入少量偏铝酸钠溶液,反应生成氯化铝和水,正确的离子方程式为:AlO2-+4H+=Al3++2H2O,故A错误;
B.二者发生氧化还原反应,正确的离子方程式为:3ClO-+H2O+SO2═SO42-+2HClO+Cl-,故B错误;
C.Cl2通入水中,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故C错误;
D.用过量氨水吸收工业尾气中的SO2,反应的离子方程式为:2NH3•H2O+SO2═2NH4++SO32-+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
16.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体.下列指定溶液中微粒浓度大小比较正确的是( )
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
17.碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图:
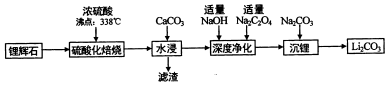
已知:碳酸锂的溶解度为((g/L)
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为((g/L)
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.
6.对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间存在关系等式Ksp=c(M+)•c(X-).现将足量的AgCl分别放入下列物质中,AgCl的溶解度最大的是( )
| A. | 60 mL 0.03 mol•L-1HCl溶液 | B. | 60 mL 0.04 mol•L-1KCl溶液 | ||
| C. | 20 mL 0.03 mol•L-1CaCl2溶液 | D. | 50 mL 0.05 mol•L-1AgNO3溶液 |
10.下列离子方程式书写不正确的是( )
| A. | 显蓝色的淀粉溶液中通入足量的SO2后变成无色溶液:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molH2O所含质子数为8NA | |
| B. | 1摩尔氦气所含的原子数为2NA | |
| C. | 在标准状况下1L水所含分子数为$\frac{1}{22.4}$NA | |
| D. | 0.5molaL与足量盐酸反应转移的电子数为1.5NA |