题目内容
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为?????????????????????? 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2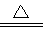 LiNH2+2LiH,氧化产物为?????????? (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的?????? %(精确到0.1)。
LiNH2+2LiH,氧化产物为?????????? (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的?????? %(精确到0.1)。
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式?????????????????????????????????????????? ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是??????????????????? 。
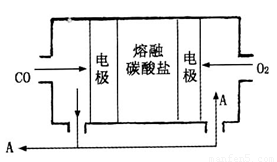
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为???????????????????????????????? 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,电池放电时负极发生的反应为Li
FePO4之间的转化,电池放电时负极发生的反应为Li C6-
C6-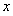 e—
e—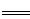
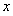 Li++6C,写出电池放电时反应的化学方程式?????????????????????? 。
Li++6C,写出电池放电时反应的化学方程式?????????????????????? 。
(1)6Li+N2 2Li3N? (2分)
2Li3N? (2分)
(2)LiNH2 (2分)? 11.4 (2分)
(3)Li2CO3+FeC2O4·2H2O+SiO2 Li2FeSiO4+CO↑+2CO2↑+2H2O(2分)
Li2FeSiO4+CO↑+2CO2↑+2H2O(2分)
防止二价铁被氧化(2分)
(4)Fe+H2PO4-+Li+-2e-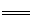 LiFePO4+2H+(或Fe-2e-
LiFePO4+2H+(或Fe-2e- Fe2+)(2分)
Fe2+)(2分)
(5)Li1-xFePO4+LixC6 LiFePO4+6C(2分)
LiFePO4+6C(2分)
【解析】
试题分析: (1)氮分子的结构很稳定,破坏分子中氮原子之间共价键需要很大的能量,所以,在通常情况下,氮气的化学性质很不活泼,很难跟其他物质发生化学反应。但在高温或放电条件下,当氮分子获得了足够的能量时,它还是能跟氢气、氧气、金属等物质发生化学反应。在高温时,氮气能跟钾、钠、镁、钙、锶、钡等金属化合。所以6Li+N2 2Li3N。
2Li3N。
(2)根据反应Li3N+2H2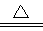 LiNH2+2LiH可判断:Li2NH中N的化合价为-3价,H为+1价,LiNH2中N的化合价为-3价,H为+1价,LiH中H的化合价为-1价,反应中H2既是氧化剂又是还原剂,氧化产物为LiNH2,还原产物为LiH;1mol Li3N可与2mol H2反应,因此储存氢气的质量比为(7×3+14):4;相当于Li3N质量的4/35=11.4%。
LiNH2+2LiH可判断:Li2NH中N的化合价为-3价,H为+1价,LiNH2中N的化合价为-3价,H为+1价,LiH中H的化合价为-1价,反应中H2既是氧化剂又是还原剂,氧化产物为LiNH2,还原产物为LiH;1mol Li3N可与2mol H2反应,因此储存氢气的质量比为(7×3+14):4;相当于Li3N质量的4/35=11.4%。
(3)草酸亚铁晶体FeC2O4·2H2O可以联想草酸的性质,H2C2O4═H2O+CO↑+CO2↑,可推测FeC2O4在密闭容器中高温分解生成氧化亚铁、一氧化碳和二氧化碳,根据原子守恒配平即可。得到Li2CO3+FeC2O4·2H2O+SiO2 Li2FeSiO4+CO↑+2CO2↑+2H2O。制备Li2FeSiO4的过程必须在惰性气体氛围中进行,肯定是排除氧气,防止氧化,这个里面只有二价铁有还原星,所以其原因是防止二价铁被氧化。
Li2FeSiO4+CO↑+2CO2↑+2H2O。制备Li2FeSiO4的过程必须在惰性气体氛围中进行,肯定是排除氧气,防止氧化,这个里面只有二价铁有还原星,所以其原因是防止二价铁被氧化。
(4)将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,铁做阳极,先失去电子,Fe-2e- Fe2+,再根据电解析出磷酸亚铁锂沉淀.二价铁再结合H+与H2PO4-生成磷酸亚铁锂,所以电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+(或Fe-2e-
Fe2+,再根据电解析出磷酸亚铁锂沉淀.二价铁再结合H+与H2PO4-生成磷酸亚铁锂,所以电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+(或Fe-2e- Fe2+)。
Fe2+)。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li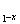 FePO4之间的转化,正极Li
FePO4之间的转化,正极Li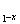 FePO4+
FePO4+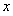 Li++
Li++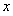 e-
e- LiFePO4,电池放电时负极发生的反应为Li
LiFePO4,电池放电时负极发生的反应为Li C6-
C6-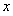 e—
e—
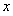 Li++6C,正极加上负极就得到电池放电时反应的化学方程式Li1-xFePO4+LixC6
Li++6C,正极加上负极就得到电池放电时反应的化学方程式Li1-xFePO4+LixC6 LiFePO4+6C。
LiFePO4+6C。
考点:考查电化学等综合知识。

 (1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,
(1)工业上可利用反应Na(1)+ KCl(1)
K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___
_____,