��Ŀ����
�Ƽ��仯������й㷺����;��
 ��1����ҵ�Ͽ����÷�ӦNa��1��+ KCl��1��
K��g��+ NaCl��1�������������أ��˷�Ӧ�������ƵĻ�ԭ�Լ�___
_____��
��1����ҵ�Ͽ����÷�ӦNa��1��+ KCl��1��
K��g��+ NaCl��1�������������أ��˷�Ӧ�������ƵĻ�ԭ�Լ�___
_____��
д������TiCl4��Ӧұ��Ti�Ļ�ѧ����ʽ______________ _______��
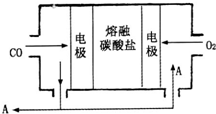
��2����Na2CO3������������ʣ�CO��O2Ϊԭ����ɵ����͵�ص��о�ȡ�����ش�ͻ�ơ��õ��ʾ��ͼ��ͼ��
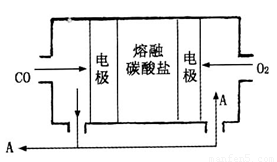
�����缫��ӦʽΪ________________��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ�����в���A���ʲμ�ѭ����A���ʵĻ�ѧʽΪ______________��
��3��Li-SOCl2��ؿ����������������õ�صĵ缫���Ϸֱ�Ϊ﮺�̼�����Һ��
LiAlCl4��SOCl2����ص��ܷ�Ӧ�ɱ�ʾΪ: 4Li + 2SOCl2 ��4LiCl + S + SO2��
��ش��������⣺
�ٵ�صĸ�������Ϊ �������ĵ缫��ӦΪ ��
�ڵ�����������ĵ缫��ӦΪ ��
��1�������Ƶķе���ڼصķе� ��

��������
���������
��1�������Ƶķе���ڽ����صķе�
4Na+ TiCl4  Ti+4 NaCl
Ti+4 NaCl
��2����Na2CO3������������ʣ�CO��O2Ϊԭ����ɵ����͵��,��ص��ܷ�ӦΪ��2CO+O2= 2CO2
���Ը����缫��ӦʽΪ��CO-2e-+ CO32-=2CO2 ͼ��ʾ����ѭ������CO2��
(3) 4Li + 2SOCl2 ��4LiCl + S + SO2��Li�Ļ��ϼ۴�0�����ߵ�+1�ۣ�Li���������ϣ������缫��Ӧ��Li-e-=Li+;���������ĵ缫��ӦΪ: 2SOCl2+ 4e-=4Cl-+S+SO2
���㣺����ȼ�ϵ�صĿ���

��10�֣��Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol��L-1����������������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A. HCN B. HClO C. CH3COOH D. H2CO3
��2��ʵ�����г���NaOH������ϴ�����ᴿ��
�ٵ�300mL 1mol��L-1��NaOH��Һ���ձ�״����4.48LCO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ__________ ______ ��
�ڼ������ӿ�ʼ����ʱ��pH���±���
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
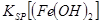 _________
_________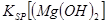 �����������������������
����������������������� ��10�֣��Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol��L-1����������������Һ��pH���±���
|
���� |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
��������Һ�е������ӣ����H+������ǿ����_________�����ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01mol��L��1���������������Һ�ֱ�ϡ��100����pH�仯������________�����ţ���
A. HCN B. HClO C. CH3COOH D. H2CO3
��2��ʵ�����г���NaOH������ϴ�����ᴿ��
�ٵ�300mL 1mol��L-1��NaOH��Һ���ձ�״����4.48LCO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ__________ ______ ��
�ڼ������ӿ�ʼ����ʱ��pH���±���
|
���� |
Fe2+ |
Cu2+ |
Mg2+ |
|
pH |
7.6 |
5.2 |
10.4 |
������ͬŨ��Cu2+��Mg2+��Fe2+���ӵ���Һ�еμ�NaOH��Һʱ��_______�������ӷ��ţ��ȳ�����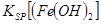 _________
_________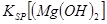 �����������������������
�����������������������
 ��2013?����ģ�⣩�Ƽ��仯������й㷺����;��
��2013?����ģ�⣩�Ƽ��仯������й㷺����;��