题目内容
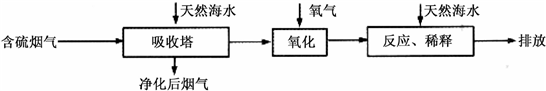
工厂排放的SO2烟气对环境造成污染,某企业用下列流程综合处理,下列有关说法正确的是

- A.二氧化硫吸收塔中发生的反应为:SO2+SO32-+H2O=2HSO3-
- B.氨气吸收塔中发生的反应为:HSO3-+OH-= H2O+SO32-
- C.上述流程利用的是氧化还原反应原理
- D.上述流程可降低碳排放,符合低碳经济
A
试题分析: A、二氧化硫吸收塔中发生的反应为:SO2+SO32-+H2O=2HSO3-,正确;B、氨气吸收塔中发生的反应为: HSO3-+ NH3=NH4++SO32-,错误;C、上述流程中没有发生氧化还原反应,错误;D、该过程吸收SO2,与低碳排放无关,错误。
考点:考查化学与STS、元素及其化合物性质。
试题分析: A、二氧化硫吸收塔中发生的反应为:SO2+SO32-+H2O=2HSO3-,正确;B、氨气吸收塔中发生的反应为: HSO3-+ NH3=NH4++SO32-,错误;C、上述流程中没有发生氧化还原反应,错误;D、该过程吸收SO2,与低碳排放无关,错误。
考点:考查化学与STS、元素及其化合物性质。

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目