题目内容
下列框图中的 A-G 是中学化学中常见的七种物质,已知常温、常压下D为无色液体,C、E 为气态单质,B 为金属单质,其它为化合物,A、G、F 焰色反应都显黄色.A-G可发生如下转化:
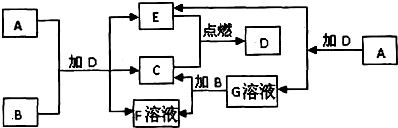
请填写下列空白:
(1)A 的化学式为 ,金属 B 原子结构示意图为 .
(2)写出 B与G溶液反应的化学方程式 ;若81gB与足量的G溶液完全反应,则转移的电子的物质的量为 ;
(3)向 F 的水溶液中通入足量的 CO2气体,其离子方程式为 .

请填写下列空白:
(1)A 的化学式为
(2)写出 B与G溶液反应的化学方程式
(3)向 F 的水溶液中通入足量的 CO2气体,其离子方程式为
考点:无机物的推断
专题:推断题
分析:框图中的A-G是中学化学中常见的七种物质,C、E为气态单质,二者在点燃条件下生成常温、常压下D为无色液体,则D为H2O,C、E分别为H2、O2中的一种,化合物A、G、F 焰色反应都显黄色,均含有Na元素,A与水反应生成生成E与G,故A为Na2O2,E为O2,G为NaOH,可推知C为H2,金属B与NaOH溶液反应生成氢气与F溶液,则B为Al,F为NaAlO2,过氧化钠与Al加水,可以得到氢气、氧气与偏铝酸钠,据此解答.
解答:
解:框图中的 A-G 是中学化学中常见的七种物质,C、E为气态单质,二者在点燃条件下生成常温、常压下D为无色液体,则D为H2O,C、E分别为H2、O2中的一种,化合物A、G、F 焰色反应都显黄色,均含有Na元素,A与水反应生成生成E与G,故A为Na2O2,E为O2,G为NaOH,可推知C为H2,金属B与NaOH溶液反应生成氢气与F溶液,则B为Al,F为NaAlO2,过氧化钠与Al加水,可以得到氢气、氧气与偏铝酸钠,
(1)由上述分析可知,A为Na2O2,B为Al,原子核外有3个电子层,各层电子数为2、8、3,其原子结构示意图为 ,
,
故答案为:Na2O2; ;
;
(2)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的化学方程式为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑,81gAl的物质的量=
=3mol,与足量的NaOH溶液完全反应,则转移的电子的物质的量为3mol×3=9mol,
故答案为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑;9mol;
(3)向 NaAlO2的水溶液中通入足量的 CO2气体,反应生成氢氧化铝沉淀与碳酸氢钠,其离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(1)由上述分析可知,A为Na2O2,B为Al,原子核外有3个电子层,各层电子数为2、8、3,其原子结构示意图为
 ,
,故答案为:Na2O2;
 ;
;(2)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的化学方程式为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑,81gAl的物质的量=
| 81g |
| 27g/mol |
故答案为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑;9mol;
(3)向 NaAlO2的水溶液中通入足量的 CO2气体,反应生成氢氧化铝沉淀与碳酸氢钠,其离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评:本题考查无机物推断,物质的颜色、状态及转化关系中特殊反应等是推断突破口,难度不大,注意基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氯碱工业中电解饱和食盐水的原理如图所示.下列说法不正确的是( )

| A、溶液A的溶质是NaOH |
| B、阴极附近溶液pH升高 |
| C、气体a为氯气,其电极反应为2Cl--2e-═Cl2↑ |
| D、与产生气体b的电极相连的是电源的正极 |
 已知 (CH3COOH)2(g)═2CH3COOH(g),经实验测得不同压强、不同温度下,体系达到平衡状态时平均摩尔质量(
已知 (CH3COOH)2(g)═2CH3COOH(g),经实验测得不同压强、不同温度下,体系达到平衡状态时平均摩尔质量(. |
| M |
| m总 |
| n总 |
| A、该过程的△H<0 |
| B、气体压强:P(a)<P(b)=P(c) |
| C、平衡常数:K(a)=K(b)<K(c) |
| D、测定乙酸的相对分子质量要在高压、低温条件下进行,以提高乙酸纯度 |
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H Ⅰ(1)如图是某烷烃球棍模型,其中的白球表示氢原子,短棍表示共价键,黑球表示C原子,则该烃名称是
Ⅰ(1)如图是某烷烃球棍模型,其中的白球表示氢原子,短棍表示共价键,黑球表示C原子,则该烃名称是 ,此烷烃的一溴代物有
,此烷烃的一溴代物有 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验. -ONa溶液的pH,其pH由大到小排列的顺序为
-ONa溶液的pH,其pH由大到小排列的顺序为