题目内容
4. 腐蚀电路板的反应为:Cu+2FeCl3═CuCl2+2FeCl2
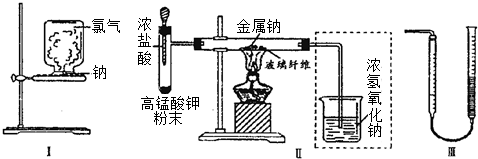
腐蚀电路板的反应为:Cu+2FeCl3═CuCl2+2FeCl2①根据该反应设计一个简易原电池,在如图方框中画出该原电池装置图,注明电极材料和电解质溶液
②负极反应式Cu-2e-═Cu2+;正极反应式2Fe3++2e-═2Fe2+.
分析 ①根据电池反应式知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液;
②负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应.
解答 解:①根据电池反应式知,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3溶液为电解质溶液,则该原电池为: ,
,
故答案为: ;
;
②负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,则负极反应式为:Cu-2e-═Cu2+,正极反应式为:2Fe3++2e-═2Fe2+,
故答案为:Cu-2e-═Cu2+;2Fe3++2e-═2Fe2+.
点评 本题考查原电池设计,为高考高频点,题目难度中等,明确原电池工作原理为解答关键,要求学生根据电池反应式确定正负极及电解质,发生氧化反应的金属作负极、活泼性不如负极材料活泼的金属或导电的非金属作正极,发生还原反应的电解质为原电池的电解质溶液,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.关于阿伏伽德罗常数NA,下列说法正确的是( )
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
4.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、CO32-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、Fe3+ |
9.关于钠及其化合物的性质的叙述,正确的是( )
| A. | 碳酸钠可用于治疗胃酸过多,作胃酸中和剂 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体少 |
16.下列变化属于物理变化的有( )
| A. | 用加热的方法分离沙子和氯化铵晶体 | |
| B. | 用洁净的铂丝蘸取氯化钠溶液在无色火焰上灼烧,焰色呈黄色 | |
| C. | 胆矾受热变成白色粉末 | |
| D. | 熔融的氯化钠导电 |
13. 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气怵 | A中试剤 | B中试剤 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HC1 | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | CO2、HC1 | NaOH溶液 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
14.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | NA个氧气分子和NA个氢气分子的质量比为16:1 | |
| B. | 54g H2O中含有的水分子数为3NA个 | |
| C. | 11.2L 氯气中含有的原子数为NA个 | |
| D. | 2L 1mol/L Na2SO4溶液中Na+离子数为2NA个 |
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.