题目内容
17.火箭推进剂燃料与氧化剂燃烧产生大量高温气体,气体膨胀并从喷嘴喷出,产生推力直到火箭达到极高的速度.请回答下列问题:若某液体推进剂由可燃剂肼(N2H4)和氧化剂X组成,X所含有的电子数和肼分子相同,且X是四核分子.
(1)写出X的电子式
 .
.(2)N2H4分子中含有的化学键类型为非极性键和极性键,其水溶液呈弱碱性的原因是H2N-NH2+H2O?H2N-NH3++OH-(用化学用语表示).
(3)常温下,若氧化剂X和肼反应生成一种常见的稳定单质和一种相对分子量为18的化合物,则该反应物的化学方程式为N2H4+2H2O2═N2+4H2O.
分析 (1)X所含有的电子数和肼分子相同,为18电子微粒,具有氧化性和肼发生氧化还原反应,且X是四核分子,判断为H2O2,属于共价化合物;
(2)肼属于共价化合物,N2H4分子中含有的化学键类型为非极性键N-N和极性键N-H,肼的水溶液呈弱碱性,肼结合水中的氢离子,促进水的电离,氢氧根离子浓度增大,溶液呈碱性;
(3)若氧化剂X和肼反应生成一种常见的稳定单质和一种相对分子量为18的化合物,说明肼和过氧化氢发生氧化还原反应生成氮气和水.
解答 解:(1)X所含有的电子数和肼分子相同,为18电子微粒,具有氧化性和肼发生氧化还原反应,且X是四核分子,应为H2O2,属于共价化合物,电子式为 ,
,
故答案为: ;
;
(2)肼属于共价化合物,N2H4分子中含有的化学键类型为非极性键N-N和极性键N-H,肼的水溶液呈弱碱性,是因为肼结合水中的氢离子,促进水的电离,氢氧根离子浓度增大,溶液呈碱性,溶液中存在平衡:H2N-NH2+H2O?H2N-NH3++OH-;
故答案为:非极性键和极性键;H2N-NH2+H2O?H2N-NH3++OH-;
(3)若氧化剂X和肼反应生成一种常见的稳定单质和一种相对分子量为18的化合物,说明肼和过氧化氢发生氧化还原反应生成氮气和水,反应的化学方程式为:N2H4+2H2O2═N2+4H2O,故答案为:N2H4+2H2O2═N2+4H2O.
点评 本题涉及物质结构,含氮化合物性质的理解应用,要求学生具有分析和解决问题的能力,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等.下列判断正确的是( )
| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
5.将SO2和SO3混合气体通入过量的BaCl2溶液中,下列说法中正确的是( )
| A. | 两种气体被完全吸收,并生成BaSO4沉淀 | |
| B. | 两种气体被完全吸收,生成BaSO3和BaSO4沉淀 | |
| C. | 两种气体均不能被吸收,没有沉淀生成 | |
| D. | 只有一种气体被吸收,生成BaSO4沉淀 |
12.雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是( )
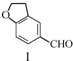 $\stackrel{CH_{2}(COOH)_{2}}{→}$
$\stackrel{CH_{2}(COOH)_{2}}{→}$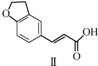 $→_{H_{2}}^{Pd-C}$
$→_{H_{2}}^{Pd-C}$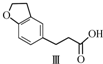
 $\stackrel{CH_{2}(COOH)_{2}}{→}$
$\stackrel{CH_{2}(COOH)_{2}}{→}$ $→_{H_{2}}^{Pd-C}$
$→_{H_{2}}^{Pd-C}$
| A. | 不能用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有10种 |
9.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 油脂在碱性条件下易水解,可用于制作肥皂 | |
| C. | 次氯酸钠具有强还原性,可用于配制“84”消毒液 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
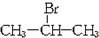 ,且烃A的结构简式为
,且烃A的结构简式为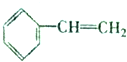 ,其在不同条件下能发生下图所示的一系列变化.
,其在不同条件下能发生下图所示的一系列变化.
 ,D
,D ,E
,E ,H
,H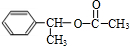 .
. +NaBr.
+NaBr. .
.