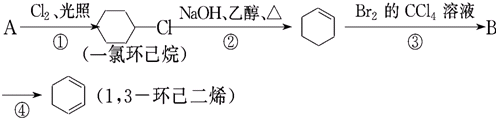
题目内容
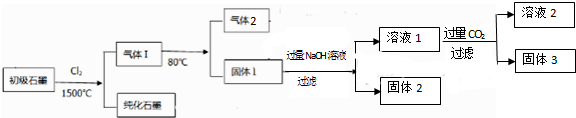
石墨是一种战略稀缺资源,初级石墨原料(含SiO2、Al2O3、Fe2O3和MgO杂质)的提纯与综合利用有重要意义,一种工艺流程如图:
已知:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.
(1)气体1为CO、SiCl4及金属氯化物,初级石墨在1500℃下通入Cl2,反应中被氧化的元素是
.
(2)分离气体1的操作名称是 ,气体2通入NaOH溶液,可生成含有硅酸钠的溶液,写出反应的化学方程式: .
(3)实验室进行过滤操作时,需要用到的主要玻璃仪器有 .固体2的主要成分是 ,溶液1中主要阳离子有 .
(4)若该初级石墨原料中含杂质SiO2、Al2O3、Fe2O3和MgO的质量分数依次为7.2%、5.1%、3.2%、2%,则100t初级石墨经充分反应得到的气体1中含CO的体积为 L(折算成标准状况).

已知:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.
(1)气体1为CO、SiCl4及金属氯化物,初级石墨在1500℃下通入Cl2,反应中被氧化的元素是
(2)分离气体1的操作名称是
(3)实验室进行过滤操作时,需要用到的主要玻璃仪器有
(4)若该初级石墨原料中含杂质SiO2、Al2O3、Fe2O3和MgO的质量分数依次为7.2%、5.1%、3.2%、2%,则100t初级石墨经充分反应得到的气体1中含CO的体积为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:根据图示可知工艺流程为:初级石墨原料的SiO2、Al2O3、Fe2O3和MgO与氯气在1500℃条件下反应生成气体ⅠCO、SiCl4及金属氯化物和纯石墨;将气体Ⅰ降低温度到80℃分离出气体2:CO、SiCl4和固体1金属氯化物;向固体1中加入过量的氢氧化钠溶液得到含有硅酸根离子、偏铝酸根的溶液1和含有固体2氢氧化铁、氢氧化镁的化合物;然后向溶液1中通入过量二氧化碳得到碳酸氢钠和氢氧化铝、硅酸沉淀,
(1)根据反应中元素的化合价变化判断被氧化的元素;
(2)分离出气体1需要降低温度到80℃;SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,据此写出反应的化学方程式;
(3)根据过滤操作方法判断需要使用的玻璃仪器名称;根据分析判断固体2的主要成分;溶液1为硅酸钠、偏铝酸钠,主要的阳离子为钠离子;
(4)生成CO的物质的量与SiO2、Al2O3、Fe2O3和MgO中的氧元素的物质的量相等,据此计算出CO的物质的量,再计算出标况下CO的体积.
(1)根据反应中元素的化合价变化判断被氧化的元素;
(2)分离出气体1需要降低温度到80℃;SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,据此写出反应的化学方程式;
(3)根据过滤操作方法判断需要使用的玻璃仪器名称;根据分析判断固体2的主要成分;溶液1为硅酸钠、偏铝酸钠,主要的阳离子为钠离子;
(4)生成CO的物质的量与SiO2、Al2O3、Fe2O3和MgO中的氧元素的物质的量相等,据此计算出CO的物质的量,再计算出标况下CO的体积.
解答:
解:根据图示可知工艺流程为:初级石墨原料的SiO2、Al2O3、Fe2O3和MgO与氯气在1500℃条件下反应生成气体ⅠCO、SiCl4及金属氯化物和纯石墨;将气体Ⅰ降低温度到80℃分离出气体2:CO、SiCl4和固体1金属氯化物;向固体1中加入过量的氢氧化钠溶液得到含有硅酸根离子、偏铝酸根的溶液1和含有固体2氢氧化铁、氢氧化镁的化合物;然后向溶液1中通入过量二氧化碳得到碳酸氢钠和氢氧化铝、硅酸沉淀,
(1)气体1为CO、SiCl4及金属氯化物,初级石墨在1500℃下通入Cl2,得到CO气体,C元素化合价升高被氧化,则反应中被氧化的元素为C,
故答案为:C;
(2)SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,则分离出气体四氯化硅需要降低温度到57.6℃~150℃之间,该操作方法为降温;
气体2为SiCl4,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,化学反应方程式为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:降温;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(3)实验室进行过滤操作时,需要用到的主要玻璃仪器有:漏斗、玻璃棒、烧杯;
固体1为金属氯化物,加入过量氢氧化钠溶液后
故答案为:漏斗、玻璃棒、烧杯;达到的固体2为Fe(OH)3、Mg(OH)2沉淀;溶液1为硅酸钠、偏铝酸钠溶液,则溶液1主要阴离子为钠离子,
故答案为:Fe(OH)3、Mg(OH)2;Na+;
(4)初级石墨中SiO2、Al2O3、Fe2O3和MgO的质量分数依次为7.2%、5.1%、3.2%、2%,100t初级石墨中含有SiO2、Al2O3、Fe2O3和MgO的质量分别为:7.2t、5.1t、3.2t、2t,物质的量分别为:n(SiO2)=
=1.2×105mol、n(Al2O3)=
=5×104mol、n(Fe2O3)=
=2×104mol、n(MgO)=
=5×104mol,
根据氧原子守恒,生成CO的物质的量为:n(CO)=n(O)=2n(SiO2)+3n(Al2O3)+3n(Fe2O3)+n(MgO)=1.2×105mol×2+5×104mol×3+2×104mol×3+5×104mol=5×105mol,
标准状况下该CO的体积为:22.4L/mol×5×105mol=1.12×107mol,
故答案为:1.12×107mol.
(1)气体1为CO、SiCl4及金属氯化物,初级石墨在1500℃下通入Cl2,得到CO气体,C元素化合价升高被氧化,则反应中被氧化的元素为C,
故答案为:C;
(2)SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,则分离出气体四氯化硅需要降低温度到57.6℃~150℃之间,该操作方法为降温;
气体2为SiCl4,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,化学反应方程式为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:降温;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(3)实验室进行过滤操作时,需要用到的主要玻璃仪器有:漏斗、玻璃棒、烧杯;
固体1为金属氯化物,加入过量氢氧化钠溶液后
故答案为:漏斗、玻璃棒、烧杯;达到的固体2为Fe(OH)3、Mg(OH)2沉淀;溶液1为硅酸钠、偏铝酸钠溶液,则溶液1主要阴离子为钠离子,
故答案为:Fe(OH)3、Mg(OH)2;Na+;
(4)初级石墨中SiO2、Al2O3、Fe2O3和MgO的质量分数依次为7.2%、5.1%、3.2%、2%,100t初级石墨中含有SiO2、Al2O3、Fe2O3和MgO的质量分别为:7.2t、5.1t、3.2t、2t,物质的量分别为:n(SiO2)=
| 7.2×106g |
| 60g/mol |
| 5.1×106g |
| 102g/mol |
| 3.2×106g |
| 160g/mol |
| 2×106g |
| 40g/mol |
根据氧原子守恒,生成CO的物质的量为:n(CO)=n(O)=2n(SiO2)+3n(Al2O3)+3n(Fe2O3)+n(MgO)=1.2×105mol×2+5×104mol×3+2×104mol×3+5×104mol=5×105mol,
标准状况下该CO的体积为:22.4L/mol×5×105mol=1.12×107mol,
故答案为:1.12×107mol.
点评:本题考查了物质的分离、提纯方法及其综合应用,题目难度中等,明确工艺流程发生的反应及操作方法为解答关键,试题侧重考查学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
相关题目
地球上氦元素主要以4He形式存在,而月球土壤中吸附着数百万吨3He,据估算3He核聚变所释放的能量可供人类使用上万年.下列说法正确的是( )
①3He、4He的化学性质基本相同
②3He、4He具有相同的中子数
③3He核聚变是化学变化
④3He液化是物理变化.
①3He、4He的化学性质基本相同
②3He、4He具有相同的中子数
③3He核聚变是化学变化
④3He液化是物理变化.
| A、①② | B、①④ | C、②③ | D、③④ |
室温下反应速率最慢的是 ( )
| A、H2+F2═2HF |
| B、H2+Br2═2HBr |
| C、Ag++Cl-═AgCl |
| D、H++OH-═H2O |
下列化合物中沸点最低的是( )
| A、CH3-(CH2)4-CH3 |
| B、CH3-(CH2)3-CH3 |
| C、CH3-CH2-CH(CH3)2 |
| D、(CH3)2C(CH3)2 |
要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
| A、甲学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是加热的 |
| B、乙学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 |
| C、丙学生:在盐酸中加入相同温度的氨水,若实验过程中温和液温度下降,说明盐类水解是吸热的 |
| D、丁学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |