题目内容
将x mol O2、y mol CH4、z mol Na2O2投入密闭容器内,在150℃条件下,电火花引发反应后,反应物均无剩余,容器内压强为零,则下列x、y、z之间的关系式中正确的是( )
| A、Z=3X+2Y |
| B、4Y=2X+Z |
| C、3X=Y+5Z |
| D、6Y=2X+Z |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:反应后容器内压强为零,所以产物H2O、CO2全部被Na2O2吸收,且气体反应物无剩余.故Na2O2足量,产物只有NaOH、Na2CO3.根据元素守恒得出正确结论.
解答:
解:反应后容器内压强为零,所以产物H2O、CO2全部被Na2O2吸收,且气体反应物无剩余.故Na2O2足量,产物只有NaOH、Na2CO3.x mol O2、y mol CH4、z mol Na2O2
根据C元素守恒,可以得到n(Na2CO3)=ymol,n(Na)=2ymol,
根据Na元素守恒,n(NaOH)=(2z-2y)mol,
根据H元素守恒,2z-2y=4y,则z=3y ①
根据O元素守恒,2x+2z=3y+2z-2y,2x=y ②
①+②得,2x+z=4y,
故选B.
根据C元素守恒,可以得到n(Na2CO3)=ymol,n(Na)=2ymol,
根据Na元素守恒,n(NaOH)=(2z-2y)mol,
根据H元素守恒,2z-2y=4y,则z=3y ①
根据O元素守恒,2x+2z=3y+2z-2y,2x=y ②
①+②得,2x+z=4y,
故选B.
点评:本题考查甲烷的燃烧,难度较大.要注意元素守恒的灵活运用是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 检查气密性 |
B、 吸收HCl |
C、 制取Fe(OH)2沉淀 |
D、 稀释浓H2SO4 |
用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极.电解过程实验数据如图乙所示.X轴表示电解过程中转移电子的物质的量,Y轴表示电解过程产生气体的总体积.则下列说法不正确的是( )


| A、电解过程中N电极表面先有红色物质生成,后有气泡产生 |
| B、A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态 |
| C、Q点时M、N两电极上产生的气体在相同条件下体积相同 |
| D、若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变 |
下列离子方程式书写不正确的是( )
| A、等物质的量的 CO2与氢氧化钠溶液反应:CO2+OH-=HCO3- | ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | ||||
| C、Ca(OH)2溶液与等物质的量的稀H2SO4混合:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O | ||||
D、用石墨电极电解饱和食盐水:2H2O+2Cl-
|
能正确表示下列反应的离子方程式的是( )
| A、NH4HSO3溶于过量的NaOH溶液中:HSO3-+OH-=SO32-+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C、Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| D、酸性KMnO4溶液与双氧水溶液反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
关于下列图示的说法中正确的( )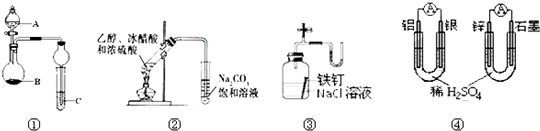

| A、图①中,若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、图②制备乙酸乙酯 |
| C、图③证明铁生锈与空气有关 |
| D、图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |

