题目内容
如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中D瓶中放有干燥红色布条;E中为铜网,E右端出气管口附近为石棉球.
试回答:
(1)A中发生反应的方程式为
(2)为得到干燥纯净的氯气,一般在B瓶中加入饱和食盐水,其作用是
(3)C中盛放的试剂为
(4)E中所发生反应的方程式为
(5)F中应加入的试剂为
(6)若A中有14.6g HCl被氧化,将产生的氯气通入足量的KI溶液中能产生单质碘的质量为
分析:(1)依据实验室是利用二氧化锰和浓盐酸加热反应生成氯气书写化学方程式;
(2)用饱和食盐水除去氯气中的氯化氢;
(3)用浓硫酸除去氯气中的水蒸气;D瓶中放有干燥红色布条,通入干燥氯气后不会褪色;
(4)E是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟;
(5)氯气有毒需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(6)依据化学方程式计算得到,注意被氧化的氯化氢和生成氯气的定量关系,氯气和碘单质的计算定量关系.
(2)用饱和食盐水除去氯气中的氯化氢;
(3)用浓硫酸除去氯气中的水蒸气;D瓶中放有干燥红色布条,通入干燥氯气后不会褪色;
(4)E是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟;
(5)氯气有毒需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(6)依据化学方程式计算得到,注意被氧化的氯化氢和生成氯气的定量关系,氯气和碘单质的计算定量关系.
解答:解:(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,故答案为:吸收HCl气体;
(3)用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用,
故答案为:浓H2SO4;红色布条不褪色;
(4)E是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,反应的化学方程式为:Cu+Cl2
CuCl2,故答案为:Cu+Cl2=CuCl2;
(5)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液;吸收多余的氯气;
(6)若A中有14.6g HCl被氧化,n(HCl)=将产生的氯气通入足量的KI溶液中能产生单质碘的质量=
=0.4mol,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;Cl2+2KI=I2+2KCl,反应中被氧化2molHCl生成1molCl2,1molCl2和碘化钾反应生成碘单质1mol
则定量计算关系为:2HCl~Cl2~I2
2 1
0.4mol 0.2mol
得到碘单质质量=0.2mol×254g/mol=50.8g;
故答案为:50.8g.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,故答案为:吸收HCl气体;
(3)用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用,
故答案为:浓H2SO4;红色布条不褪色;
(4)E是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,反应的化学方程式为:Cu+Cl2
| ||
(5)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液;吸收多余的氯气;
(6)若A中有14.6g HCl被氧化,n(HCl)=将产生的氯气通入足量的KI溶液中能产生单质碘的质量=
| 14.6g |
| 36.5g/mol |
MnO2+4HCl(浓)
| ||
则定量计算关系为:2HCl~Cl2~I2
2 1
0.4mol 0.2mol
得到碘单质质量=0.2mol×254g/mol=50.8g;
故答案为:50.8g.
点评:本题考查了实验室制备氯气的装置分析和除杂试剂选择,氯气性质验证的反应现象判断,注意氯气是有毒气体,不能排放到空气中,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图为实验室制取乙炔并验证其性质的装置图.下列说法不合理的是( )
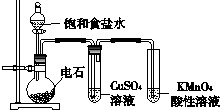

| A、逐滴加入饱和食盐水可控制生成乙炔的速率 | B、KMnO4酸性溶液褪色,说明乙炔具有还原性 | C、用Br2的CCl4溶液验证乙炔的性质,不需要除杂 | D、将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高 |


