题目内容
(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,减小压强可使平衡发生移动,则平衡向____________(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是____________(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)____________v(b)(填“>”、“<”或“=”);

(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(H+)的比值为_________________;
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,则( )
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,则( )
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5(mol•L﹣1)3
Ni(s)+4CO(g)的平衡常数为0.5(mol•L﹣1)3
C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:(1)以上步骤有错误的是(填编号)___________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_________;
(2)判断滴定终点的现象是:锥形瓶中溶液从__________色变为__________色,且半分钟不变色;
(3)下图是某次滴定时的滴定管中的液面,其读数为__________mL;
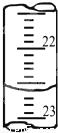
(4)根据下列数据:请计算待测盐酸溶液的浓度:__________mol/L.
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |


 2N2(g)+6H2O(g) ①
2N2(g)+6H2O(g) ①
 NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是