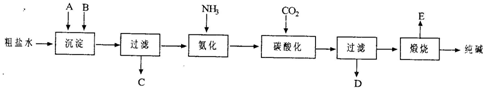
题目内容
配制500ml 1.0mol/L 稀H2SO4,需要18mol/L 浓H2SO4约多少ml?( )
分析:根据溶液稀释前后溶质的物质的量不变计算,计算公式可用c(稀)×V(稀)=c(浓)×V(浓).
解答:解:溶液稀释前后溶质的物质的量不变,根据c(稀)×V(稀)=c(浓)×V(浓),
则有:0.5L×1.0moL/L=V×18moL/L,
V=
=0.028L,即28ml.
故选C.
则有:0.5L×1.0moL/L=V×18moL/L,
V=
| 0.5L×1.0mol/L |
| 18moL/L |
故选C.
点评:本题考查物质的量浓度的相关计算,题目难度不大,注意利用c(稀)×V(稀)=c(浓)×V(浓)计算.

练习册系列答案
相关题目