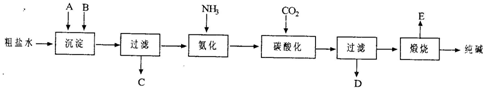
题目内容
配制500mL 1.0mol·L—1的NaOH溶液时,下列哪些操作会使实验结果偏高_____________;偏低__________;无影响______________。
A. 称量时,直接把氢氧化钠放在纸上称量,且称量时间过长
B. 称量时,固体放在右盘,砝码放在左盘
C. 称量时所用砝码生锈
D. 原容量瓶用蒸馏水洗净后未干燥
E . 移液后,未洗涤烧杯和玻璃棒
F. 定容时,俯视刻度线
G. 颠倒摇匀溶液后,发现液面低于刻度线,再补加水到刻度线
H. 溶液尚未冷却到室温就注入容量瓶进行定容
【答案】
偏高(CFH)偏低(ABEG)无影响(D)
【解析】略

练习册系列答案
相关题目