题目内容
4. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )| A. | 化学方程式为:2M?N | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t3时,正反应速率等于逆反应速率 | D. | t1时,N的浓度是M浓度的3倍 |
分析 在t2时,N的物质的量为4mol,变化4mol,M的物质的量为4mol,变化2mol,反应的方程式为2N?M,结合图象解答该题.
解答 解:A.在t2时,N的物质的量为4mol,变化4mol,M的物质的量为4mol,变化2mol,反应的方程式为2N?M,故A错误;
B.t2时,M、N物质的量还在变化,所以没有达到平衡状态,故B错误;
C.t3时,达到平衡状态,则正逆反应速率相等,故C正确;
D.t1时,N的物质的量为6mol,M的物质的量为3mol,则N的浓度是M浓度的2倍,故D错误;
故选C.
点评 本题考查化学平衡与图象问题的考查,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线变化的趋势以及平衡状态的判断.

练习册系列答案
相关题目
5.下列事实和解释正确的是( )
| A. | 锌与稀盐酸反应,加入NaCl固体后反应速率加快是因为增大了Cl-的浓度 | |
| B. | 面粉厂内要禁止明火是因为固体表面积大会加快反应速率 | |
| C. | 5%的H2O2中加入MnO2粉末后分解速率迅速加快是因为MnO2粉末降低了反应的焓变 | |
| D. | 锌与稀盐酸反应滴入CuSO4稀溶液反应速率变慢是因为CuSO4溶液中的水降低了硫酸的浓度 |
15.下列说法不正确的是( )
| A. | 水结成冰体积膨胀与氢键的作用有关 | |
| B. | DNA中的碱基互补配对是通过氢键来实现的 | |
| C. | 纯硫酸是一种粘稠状液体与分子间存在氢键有关 | |
| D. | HF、HCl、HBr、HI的熔点随相对分子质量增大而升高 |
12.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
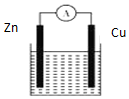

| A. | 产生1 g H2,消耗锌的质量65 g | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置不可实现化学能全部转化为电能 | |
| D. | 铜做正极发生还原反应 |
19.比较下列各组物质的沸点,正确的是( )
| A. | 乙醇>丙烷 | B. | 正丁烷>苯 | C. | 1-丁烯>1-庚烯 | D. | 甲醛>乙醛 |
9.关于卤素(F、Cl、Br、I)的性质的叙述,错误的是( )
| A. | 卤素单质的密度逐渐增大 | |
| B. | 将氯水加到KI淀粉溶液中,溶液变蓝 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2能从NaCl溶液中置换出Cl2 |
16.下列叙述所对应的物质一定为纯净物的是( )
| A. | 焦炭在氧气中燃烧所得到的产物 | |
| B. | 从市场上购得的漂白粉 | |
| C. | 实验室用MnO2固体和浓盐酸反应,从气体发生装置中导处的气体 | |
| D. | 将氟气与氢气以等物质的量,在冷暗处充分混合 |
13.短周期元素X、Y、Z、W的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10,X、Z原子的最外层电子数之和等于Y原子的次外层电子数,X与Z,Y与W均为同主族元素.下列叙述正确的是( )
| A. | Z、W单质的熔点:Z>W | |
| B. | 最高价氧化物对应的水化物的酸性:Y>W | |
| C. | 四种元素的原子半径:X>Y>Z>W | |
| D. | Z元素处于元素周期表中第三周期第ⅡA族 |