题目内容
9.Al、Mg混合物与适量的稀硫酸恰好完全反应,将溶液蒸干得固体质量比原固体增加了4.8g,则该混合物的物质的量可能为( )| A. | 0.03 mol | B. | 0.04 mol | C. | 0.05 mol | D. | 0.06 mol |
分析 反应后溶液蒸干为硫酸铝、硫酸镁,由质量守恒定律可知,固体质量增重为硫酸根的质量,根据n=$\frac{m}{M}$计算硫酸根的物质的量,若为硫酸镁,金属物质的量最大,若为硫酸铝,金属的物质的量最小,据此解答.
解答 解:反应后溶液蒸干为硫酸铝、硫酸镁,由质量守恒定律可知,固体质量增重为硫酸根的质量,硫酸根物质的量为:$\frac{4.8g}{96g/mol}$=0.05mol,
若只有硫酸镁,金属的物质的量最多,n(Mg)=n(MgSO4)=0.05mol,
若只有硫酸铝,金属的物质的量最少,n(Al)=2n[Al2(SO4)3]=2×$\frac{1}{3}$×0.05mol=0.033mol,
故金属的物质的量介于0.033mol~0.05mol之间,
故选B.
点评 本题考查混合物的计算,难度中等,确定固体增重为硫酸根的质量是关键,注意利用极限法确定计算金属物质的量范围.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
19.在含有下列离子组的溶液中,加入Fe(NO3)2固体后,仍然能够大量共存的离子组是( )
| A. | K+、SO42-、NH4+、CO32- | B. | K+、Ba2+、OH-、Cl- | ||
| C. | Na+、H+、Cl-、SO42- | D. | Na+、Mg2+、Cl-、NO3- |
4.在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为( )
| A. | 2A+3B═2C | B. | A+3B═2C | C. | 3A+2B═3C | D. | A+B═C |
1.下列图示与对应的叙述相符的是( )
| A. | 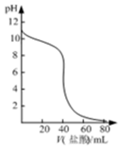 表示常温下盐酸滴加到0.1mol/L某强碱溶液得到的滴定曲线 | |
| B. | 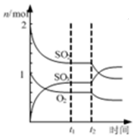 表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| C. | 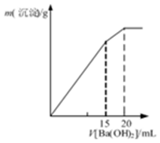 表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 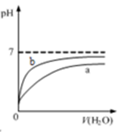 表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
18.在标准状况下,下列物质占体积最大的是( )
| A. | 18g H2O | B. | 6.02×1023个氮分子 | ||
| C. | 44.8L HCl | D. | 6g氢气 |
19.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2 L N2含有分子数为0.5 NA | |
| B. | 在常温常压下,22.4 L Ne含有分子数为NA | |
| C. | 71 g Cl2所含原子数为2 NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数相同 |
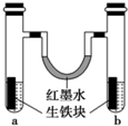 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一. 回答下列问题:
回答下列问题: