题目内容
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素。下列说法错误的是
| | W | Z |
| X | Y | |
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y>X
D.W、Z的氧化物都能与碱反应生成盐和水
D
解析试题分析:A选项原子半径与电子层数成正比,与核电核数成反比,正确。B选项X为铝,Y为Si,W为C,Z为N。所以SiO2能与NaOH反应,正确。C选项气态氢化物的稳定性和非金属性成正比,Y>X,正确。D选项CO不与碱反应,错误。
考点:考察学生元素推断和元素周期律的相关知识。

练习册系列答案
相关题目
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| | X | Y | Z | M | R | Q |
| 原子半径/nm | | | 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合价 | | -4,+4 | | -2 | -1,+7 | +3 |
| 其它 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 | | | |
下列说法正确的是
A.X与M形成的化合物中含有离子键
B.Z、M、Q三种元素的简单离子的半径:M>Z>Q
C.Y与R形成的化合物中R呈正价,说明Y的非金属性比R强
D.在元素周期表中,Q位于金属与非金属的交界处,可以作半导体材料
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且将a、b相连浸入稀硫酸中时,a溶解而b表面有气泡产生;c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A.a、b、e、d、c | B.e、d、a、b、c |
| C.b、a、e、d、c | D.a、b、d、c、e |
四种短周期元素在周期表中的相对位置如右表所示,下列说法错误的是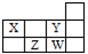
| A.X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B.Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C.X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D.W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4
随着卤素原子半径的增加,下列递变规律正确的是( )
| A.单质的熔沸点逐渐降低 | B.卤素离子的还原性逐渐增强 |
| C.最高正化合价逐渐增大 | D.单质的氧化性逐渐增强 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.X2-的还原性一定大于Y- |
| B.由mXa+与nYb-得m+a=n-b |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |