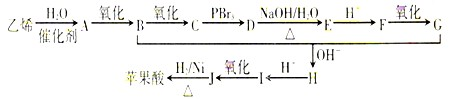
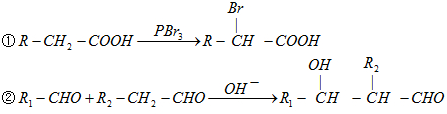题目内容
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A、X、M两种元素只能形成X2M型化合物 |
| B、元素Y、Z、W的单质晶体属于同种类型的晶体 |
| C、元素W和M的某些单质可作为水处理中的消毒剂 |
| D、由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、M五种短周期元素,Y的单质是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,据此解答.
解答:
解:X、Y、Z、W、M五种短周期元素,Y的单质是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,
A.X、M两种元素形成的化合物可以是氧化钠或过氧化钠,故A错误;
B.硅单质为原子晶体,硫、氯气形成分子晶体,故B错误;
C.氯气、臭氧可作为水处理中的消毒剂,故C正确;
D.由于水分子之间有氢键的存在,通常条件下为也为液体,而HCl、H2S为气态,水的沸点最高,故D错误,
故选C.
A.X、M两种元素形成的化合物可以是氧化钠或过氧化钠,故A错误;
B.硅单质为原子晶体,硫、氯气形成分子晶体,故B错误;
C.氯气、臭氧可作为水处理中的消毒剂,故C正确;
D.由于水分子之间有氢键的存在,通常条件下为也为液体,而HCl、H2S为气态,水的沸点最高,故D错误,
故选C.
点评:本题考查位置结构性质关系应用,难度不大,“Y单质是一种重要的半导体材料、X+与M2-具有相同的电子层结构”是推断突破口,注意对基础知识的积累掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分子式为C5H12O的饱和一元醇,其分子中含有两个-CH3、两个-CH2-、一个 和一个-OH,它的可能的结构有( )
和一个-OH,它的可能的结构有( )
 和一个-OH,它的可能的结构有( )
和一个-OH,它的可能的结构有( )| A、3种 | B、5种 | C、4种 | D、6种 |
将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液呈( )
| A、碱性 | B、酸性 |
| C、中性 | D、无法确定 |
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0.下列研究目的和图示相符的是( )
| A | B | C | D | |
| 研究 目的 | 温度(T)对反应的影响(T2>T1) | 压强(p)对平衡常数的影响 | 温度(T)对反应的影响 | 压强(p)对反应的影响(p2>p1) |
| 图示 |  |  |  |  |
| A、A | B、B | C、C | D、D |
若某原子的摩尔质量是M g?mol-1,阿伏加德罗常数为NA mol-1,一个12C的质量为m g,则一个该原子的真实质量是( )
A、
| ||
B、
| ||
| C、M?NA g | ||
D、
|
下列关于胶体与溶液的说法正确的是( )
| A、胶体与溶液的本质区别在于能否发生丁达尔效应 |
| B、利用滤纸可以分离胶体与溶液 |
| C、向沸水中滴加饱和氯化铁溶液可制得氢氧化铁胶体 |
| D、蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象 |
将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为( )mol/L.
A、
| ||
B、
| ||
C、
| ||
D、
|