��Ŀ����
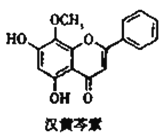
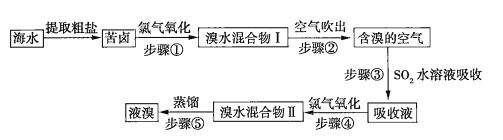
����Ŀ��ij�ֵ�Ʒ�ˮ��A�����ӣ��ŷ�ǰ�Ĵ����������£�
��֪��4.5g����D�����������պ���4.0g��ɫ���壬���ɵ���ɫ��ζ����ͨ����������ʯ��ˮʱ������5.0g��ɫ���������õ��Ļ�������ȥ������ʣ���״�����ܶ�Ϊ1.25g��L-1�ĵ�������E 560mL��
(1)E�ĽṹʽΪ____________��
(2)д������D�����������շ����Ļ�ѧ����ʽ_______________________________��
(3)��ҺB��������____________(������������������ԭ����)��
(4)��ҺC�л���������A���ӣ�ͨ����Ӧ�ڣ��ɽ���ת��Ϊ�Ի����������ʣ������ӷ���ʽ��ʾ�÷�ӦΪ______________________________________��
���𰸡�![]() 2CuCN+3O2
2CuCN+3O2![]() 2CuO+2CO2��+N2�� ��ԭ�� 2CN-+5ClO-+2H+=5Cl-+2CO2��+N2��+H2O
2CuO+2CO2��+N2�� ��ԭ�� 2CN-+5ClO-+2H+=5Cl-+2CO2��+N2��+H2O
��������
��������E��Ħ������Ϊ1.25g��L-1��22.4L��mol-1=28g��mol-1����EΪN2����n(N2)=![]() =0.025mol������D����Cu�����պ�����ĺ�ɫ����ΪCuO��������ɫ��ζ����ΪCO2��n(CuO)=
=0.025mol������D����Cu�����պ�����ĺ�ɫ����ΪCuO��������ɫ��ζ����ΪCO2��n(CuO)=![]() =0.5mol��n(CO2)= n(CaCO3)=
=0.5mol��n(CO2)= n(CaCO3)=![]() =0.05mol����D�к���0.05mol Cu��0.05mol C��0.05mol N����4.5g����D�в�������Ԫ�أ�����DΪCuCN����A����ΪCN-��
=0.05mol����D�к���0.05mol Cu��0.05mol C��0.05mol N����4.5g����D�в�������Ԫ�أ�����DΪCuCN����A����ΪCN-��
��1����������EΪN2����ṹʽΪ![]() ��
��
��2��DΪCuCN�������յĻ�ѧ����ʽ2CuCN+3O2![]() 2CuO+2CO2��+N2����
2CuO+2CO2��+N2����
��3������֪��Cu(II)��Cu(I)���ù�����Ҫ��ԭ����A��Һ�����ֻ�ԭ�ԣ���B��Һ���л�ԭ�ԣ�
��4���ô������ư�CN-����Ϊ���Ķ�����̼�͵��������ӷ���ʽΪ2CN-+5ClO-+2H+=5Cl-+2CO2��+N2��+H2O��

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�����Ŀ����I����֪��448��ʱ����ӦH2(g)��I2(g)![]() 2HI(g)��ƽ�ⳣ��K1Ϊ49������¶��·�Ӧ
2HI(g)��ƽ�ⳣ��K1Ϊ49������¶��·�Ӧ![]() H2(g)��
H2(g)��![]() I2(g)
I2(g)![]() HI(g)��ƽ�ⳣ��K2Ϊ____________��
HI(g)��ƽ�ⳣ��K2Ϊ____________��
��II����һ��������ܱ������н������»�ѧ��Ӧ��CO2(g)��H2(g)![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��(K)���¶�(t)�Ĺ�ϵ�����ʾ��
CO(g)��H2O(g)���仯ѧƽ�ⳣ��(K)���¶�(t)�Ĺ�ϵ�����ʾ��
t/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��________��
��2���÷�ӦΪ________(����ȡ����ȡ�)��Ӧ��
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________��
A.������ѹǿ���� B.���������c(CO)����
C.v��(H2)��v��(H2O) D.c(CO2)��c(CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c(CO2)��c(H2)��c(CO)��c(H2O)�����жϴ�ʱ���¶�Ϊ________�档
��5����800��ʱ������������Ӧ��ijʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊc(CO2)Ϊ2mol��L��1��c(H2)Ϊ1.5mol��L��1��c(CO)Ϊ1mol��L��1��c(H2O)Ϊ3mol��L��1������һʱ�̣���Ӧ��________(���������)���С�