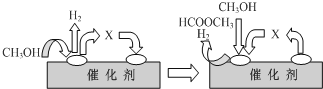
题目内容
18.有一种星际分子,其分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、叁键等,不同花纹的球表示不同的原子).对该物质判断正确的是( )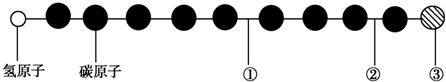
| A. | 该物质是烃的含氧衍生物 | B. | ①处的化学键是碳碳双键 | ||
| C. | ②处的化学键是碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
分析 该分子为有机物,有机物分子中碳原子形成了4个共价键,从左边氢原子开始推断,第一个碳碳键为碳碳三键,第二个碳碳键为单键,第三个为三键,同理可推出①为碳碳三键,②为碳碳单键,③与其相连的碳应该为三键,即结构简式为:HC≡C-C≡C-C≡C-C≡C-C≡③,据此进行判断.
解答 解:A.该化合物不含O,因此不是烃的含氧衍生物,故A错误;
B.①处的键为碳碳三键,故B错误;
C.②处的键为碳碳单键,故C正确;
D.③原子形成的键为三键,所以不可能为氟原子或者氯原子,故D错误;
故选C.
点评 本题考查有机物中碳的成键特征,是对学生综合能力的考查与知识的运用,解题关键是根据有机物中碳原子形成的共价键数目推断有机物中存在的化学键,难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
12.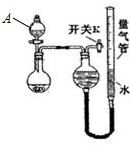 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3•H2O
④Zn2+易形成配合物如[Zn(NH3)4]2+,该配合物遇强酸分解生成Zn2+、NH4+(1)(1)甲同学取镁铝合金进行定量分析,用图所示装置进行实验,获得如下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
(2)乙同学取镁铝锌合金设计如下实验方案:
(可用试剂:样品、pH试纸、稀硫酸、NaOH溶液、氨水)
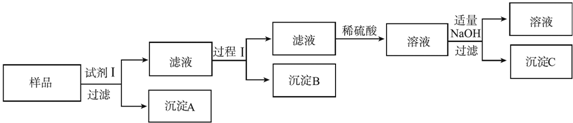
①试剂Ⅰ是NaOH溶液;沉淀B是Al(OH)3.
②过程Ⅰ是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水,过滤.
③沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3•H2O=[Zn(NH3)4]2++2OH-+4H2O.
 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3•H2O
④Zn2+易形成配合物如[Zn(NH3)4]2+,该配合物遇强酸分解生成Zn2+、NH4+(1)(1)甲同学取镁铝合金进行定量分析,用图所示装置进行实验,获得如下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |
(可用试剂:样品、pH试纸、稀硫酸、NaOH溶液、氨水)

①试剂Ⅰ是NaOH溶液;沉淀B是Al(OH)3.
②过程Ⅰ是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水,过滤.
③沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3•H2O=[Zn(NH3)4]2++2OH-+4H2O.
13.下列反应中,调节反应物用量不会改变反应产物的是( )
| A. | CO2通入澄清石灰水中 | B. | 稀硝酸中加入铜片 | ||
| C. | 稀硝酸中加入铁屑 | D. | HCl溶液滴入Na2CO3溶液中 |
3.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为NA | |
| B. | 1molNa2O2固体中含阴离子总数为2NA | |
| C. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| D. | 100mL12mol•L-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA |
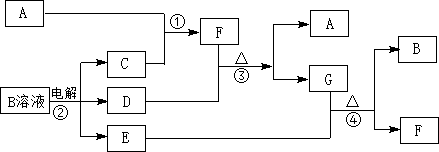 (1)写出化学式FNH3,
(1)写出化学式FNH3, .
.
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):