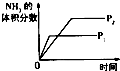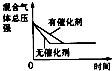��Ŀ����
����Ŀ�����������ǻ�ѧ��ҵ�г��õ����������л��ϳ��еĴ���������Ҫ�Ʊ�������̼�����ȷֽ⣬��Ӧԭ��Ϊ2MnCO3+ O2![]() 2MnO2+2CO2�����о����ָ÷�Ӧ����Ϊ��MnCO3
2MnO2+2CO2�����о����ָ÷�Ӧ����Ϊ��MnCO3![]() MnO+ CO2����2MnO +O2
MnO+ CO2����2MnO +O2![]() 2MnO2��
2MnO2��
�ش��������⣺
��1��ij�¶��¸�ƽ����ϵ��ѹǿΪP��CO2��O2�����ʵ����ֱ�Ϊn1��n2����ƽ���ѹ����ƽ��Ũ�ȣ�̼�����ȷֽⷴӦ��ƽ�ⳣ��K=________(��ѹ=��ѹ�����ʵ�������)��K�뷴Ӧ��������ƽ�ⳣ��K1��K2�Ĺ�ϵΪ_________________��
��2����Ӧ���ڵ��������Է����У�������H__________0 (����>������<������=��)��
���𰸡� ![]() K = K12K2 <
K = K12K2 <
�������������������1����������������Ӧ����ʽ֪��̼�����ȷֽⷴӦ��ƽ�ⳣ������ʽK��P2��CO2��/P��O2����![]() ��K1= P��CO2����K2=1/P��O2����K��K1��K2��ϵΪ
��K1= P��CO2����K2=1/P��O2����K��K1��K2��ϵΪ![]() ��
��
��2������H��T��S��0ʱ��Ӧ�Է����У���Ӧ��Ϊ�������ʵ������ٵ��ؼ���Ӧ����S��0�����ڵ��������Է����У�������H��0��

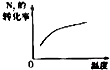
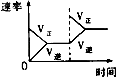
����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ������ǣ� ��
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A.A
B.B
C.C
D.D
����Ŀ��X��Y��Z��R��M��Ԫ�����ڱ���ԭ������������������ֶ�����Ԫ�أ��������Ϣ���±���
Ԫ�� | �����Ϣ |
X | X��һ�ֺ��ص�ԭ�Ӻ���û������ |
Y | Yԭ�ӵĺ������ռ��4��ԭ�ӹ�� |
Z | Z����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ���� |
R | R�ǵؿ��к�����ߵ�Ԫ�� |
M | M�ĵ�������ˮ���ҷ�Ӧ�����ɵ�ǿ���к��е�������ͬ���������� |
��1��Y��Z��R�ĵ�һ�����ܴӴ�С��˳��������Ԫ�ط��ţ�
��2��Z��R������⻯�����ȶ���ǿ���� �� �е�ߵ������ѧʽ��
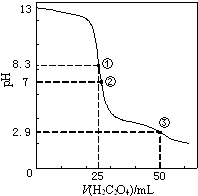
��3������������3��Ԫ����ɵij��������������pH=3�ļ���Һ����ˮ����c��H+��=10��3mol/L����Ļ�ѧʽ�� ��
��4��ֱ���ͷ���Y2Z2������ԭ�Ӷ��ﵽ8�����ȶ��ṹ��������ЦҼ���м��ĸ���֮���� ��
��5��������0.58gY4H10��ȫȼ�շų�29kJ����������д��Y4H10ȼ���ȵ��Ȼ�ѧ����ʽ ��