题目内容
铅及其化合物可用于蓄电池,耐酸设备及X射线防护等.回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 周期,第 族:非金属氧化物的水化物酸性Pb比C的 (填“强”或“弱”).
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 :PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生的电极反应式 ,阴极观察到的现象是 :若电解液中不加入Cu(NO3)2,阴极发生的电极反应式 ,这样做的主要缺点是 .
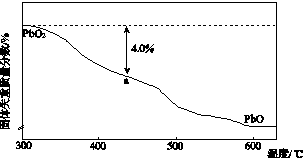
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(
×100%)的残留固体,若a点固体表示为PbO2或mPbO2?nPbO,列式计算x值和m:n值 .
(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(
| 样品起始质量-a点固体质量 |
| 样品起始质量 |

考点:碳族元素简介,电解原理
专题:电化学专题,元素及其化合物
分析:(1)C、Pb属于同一主族元素,Pb比C多4个电子层,则Pb含有6个电子层;元素非金属性越强,其最高价氧化物的水化物酸性越强;
(2)二氧化铅和浓盐酸反应生成氯气,同时生成氯化铅和水;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠;电解时,阳极上铅离子失电子和水反应生成二氧化铅;
阴极上铜离子放电;若电解液中不加入Cu(NO3)2,阴极上铅离子得电子生成铅;
(4)若a点固体组成表示为PbOx,根据PbO2
PbOx+
O2↑列方程计算x的值;若组成表示为mPbO2?nPbO,则O原子与Pb原子的比值为x,据此计算解答.
(2)二氧化铅和浓盐酸反应生成氯气,同时生成氯化铅和水;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠;电解时,阳极上铅离子失电子和水反应生成二氧化铅;
阴极上铜离子放电;若电解液中不加入Cu(NO3)2,阴极上铅离子得电子生成铅;
(4)若a点固体组成表示为PbOx,根据PbO2
| ||
| 2-x |
| 2 |
解答:
解:(1)C、Pb属于同一主族元素,Pb比C多4个电子层,则Pb含有6个电子层,则Pb位于第六周期第IVA族;元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性C>Pb,所以元素最高价氧化物的水化物酸性Pb的比C的酸性弱,故答案为:6;IVA;弱;
(2)PbO2与浓盐酸共热生成黄绿色气体,说明二者反应生成氯气,同时生成氯化铅和水,反应方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O,故答案为:PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-;电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;
阴极上铜离子放电生成Cu单质,所以阴极上有铜析出;
若电解液中不加入Cu(NO3)2,阴极上铅离子得电子生成铅,电极反应式为Pb2++2e-=Pb;Pb2+生成PbO2的量减少,则Pb2+利用率降低,
故答案为:PbO+ClO-=PbO2+Cl-;Pb2++2H2O-2e-=PbO2↓+4H+;有红色物质析出;Pb2++2e-=Pb;Pb2+利用率降低;
(4)若a点固体组成表示为PbOx,根据PbO2
PbOx+
O2↑,
×32=239×4.0%,x=1.4;
若组成为mPbO2?nPbO,根据原子守恒得,O原子和Pb原子的比值=x=
=1.4,得m:n=2:3,
故答案为:
×32=239×4.0%,x=1.4;
=1.4,得m:n=2:3.
(2)PbO2与浓盐酸共热生成黄绿色气体,说明二者反应生成氯气,同时生成氯化铅和水,反应方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O,故答案为:PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O;
(3)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-;电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;
阴极上铜离子放电生成Cu单质,所以阴极上有铜析出;
若电解液中不加入Cu(NO3)2,阴极上铅离子得电子生成铅,电极反应式为Pb2++2e-=Pb;Pb2+生成PbO2的量减少,则Pb2+利用率降低,
故答案为:PbO+ClO-=PbO2+Cl-;Pb2++2H2O-2e-=PbO2↓+4H+;有红色物质析出;Pb2++2e-=Pb;Pb2+利用率降低;
(4)若a点固体组成表示为PbOx,根据PbO2
| ||
| 2-x |
| 2 |
| 2-x |
| 2 |
若组成为mPbO2?nPbO,根据原子守恒得,O原子和Pb原子的比值=x=
| 2m+n |
| m+n |
故答案为:
| 2-x |
| 2 |
| 2m+n |
| m+n |
点评:本题考查碳族元素性质,涉及物质的量的有关计算、离子反应、电解原理等知识点,注意(3)中阳极、阴极电极反应式的书写,注意(4)中的计算,为易错点.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )


| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08mol?L-1?min-1 |
| B、若0~5min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中充入1mol He,此时v正>v逆 |
| D、200℃时,平衡后再充入2mol C,则达到平衡时,C的体积分数等于0.25 |
