题目内容
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质.气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物及水已略去).

请回答下列问题:
(1)写出乙与丙生成B的化学方程式:
(2)写出甲和A溶液反应的离子方程式:
(3)检验E中阳离子时,取少量E于试管中 则证明E中有该阳离子.
(4)写出实验室制取B的化学方程式:
(5)工业上用B作原料制备某酸,写出该酸的浓溶液在常温下与某金属反应,生成绿色溶液的化学方程式: .

请回答下列问题:
(1)写出乙与丙生成B的化学方程式:
(2)写出甲和A溶液反应的离子方程式:
(3)检验E中阳离子时,取少量E于试管中
(4)写出实验室制取B的化学方程式:
(5)工业上用B作原料制备某酸,写出该酸的浓溶液在常温下与某金属反应,生成绿色溶液的化学方程式:
考点:无机物的推断
专题:推断题
分析:乙、丙、丁为单质,一定条件下乙与丙反应得到B,丙、丁在点燃条件下反应得到C,且B与C相遇生成大量白烟生成E,由反应条件下可知B为NH3,C为HCl,则丙为H2,乙为N2,丁应为Cl2,E为NH4Cl,NH4Cl与强碱A反应生成NH3与D,且D是海水中浓度最高的盐,应为NaCl,则A为NaOH,甲是日常生活中常见的金属,能与NaOH反应生成氢气,则E为Al,结合对应物质的性质解答该题.
解答:
解:乙、丙、丁为单质,一定条件下乙与丙反应得到B,丙、丁在点燃条件下反应得到C,且B与C相遇生成大量白烟生成E,由反应条件下可知B为NH3,C为HCl,则丙为H2,乙为N2,丁应为Cl2,E为NH4Cl,NH4Cl与强碱A反应生成NH3与D,且D是海水中浓度最高的盐,应为NaCl,则A为NaOH,甲是日常生活中常见的金属,能与NaOH反应生成氢气,则E为Al,
(1)乙与丙生成B的反应为工业制备氨气的反应,方程式为N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
(2)甲和A溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)E中所含阳离子为NH4+,检验方法为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+,
故答案为:加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝;
(4)实验室用氯化铵和氢氧化钙在加热条件下反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(5)工业上用B作原料制备某酸,应生成硝酸,硝酸的浓溶液在常温下与某金属反应,生成绿色溶液,则应生成硝酸铜,
反应的化学方程式为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O.
(1)乙与丙生成B的反应为工业制备氨气的反应,方程式为N2+3H2
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
(2)甲和A溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)E中所含阳离子为NH4+,检验方法为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+,
故答案为:加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝;
(4)实验室用氯化铵和氢氧化钙在加热条件下反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(5)工业上用B作原料制备某酸,应生成硝酸,硝酸的浓溶液在常温下与某金属反应,生成绿色溶液,则应生成硝酸铜,
反应的化学方程式为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O.
点评:本题考查无机物的推断,反应现象及焰色反应等时推断的突破口,再结合转化关系中特殊反应进行推断,难度不大,注意对基础知识的掌握.

练习册系列答案
相关题目
下列有关同分异构体数目的叙述中,不正确的是( )
| A、甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B、分子式符合C5H11Cl的化合物有6种 |
| C、已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
下列说法中正确的是( )
| A、500mL 1mol?L-1 MgCl2溶液中含有Cl-数目为0.5NA |
| B、标准状况下,1mol H2O与1mol O2所占的体积相等 |
| C、1mol S与足量Cu反应生成Cu2S,转移的电子数为NA |
| D、常温常压下,1mol氦气所含的原子数为NA |
当光束通过下列物质时:①豆浆②稀硫酸③蒸馏水④淀粉溶液,没有丁达尔现象的分散系是( )
| A、②③④ | B、②④ | C、②③ | D、② |
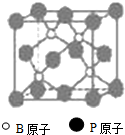 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr. 外,还有
外,还有 (1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为
(1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为